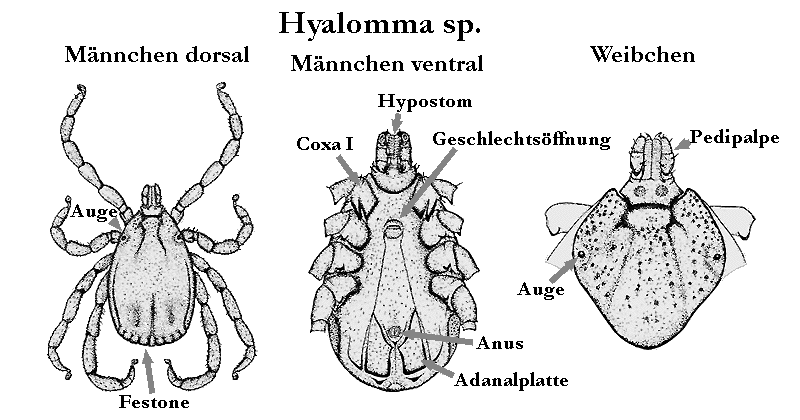
VIII.4 Hyalomma Koch, 1844
Inhaltsverzeichnis:
- VIII.4.1Kurzbeschreibung der Gattung
- VIII.4.2Schlüssel zur Differenzierung der Hyalomma-Taxa „marginatum” und „aegyptium”
- ❍Weibchen
- ❍Männchen
- ❍Bestimmungsschlüssel der Männchen von europäischen Hyalomma-Arten
- ❍Tabelle der differenzierenden Merkmale von vier Taxa der „marginatum”-Gruppe
- ❍Bestimmungsschlüssel der Adulttiere von Arten der Hyalomma marginatum-Gruppe
- VIII.4.3Kurzbeschreibung von in Europa nachgewiesenen Hyalomma-Arten,die aber in Zentraleuropa mit hoher Wahrscheinlichkeit nicht vorkommen
- ❍Hyalomma excavatum
- ❍Hyalomma (Euhyalomma) dromedarii
- ❍Hyalomma (Hyalomma) lusitanicum
- ❍Hyalomma scupense
- VIII.4.4Einzelbeschreibung der Arten,die in Zentraleuropa heimisch sind oder mit hoher Wahrscheinlichkeit vorkommen
- ❍Hyalomma marginatum
- ❍Hyalomma aegyptium, ein in Österreich nachgewiesener Irrgast
VIII.4.1 Kurzbeschreibung der Gattung Hyalomma
- Benennung: Schildzecken - Hard Ticks - Ixodidés - garrapatas duras
- Klassifikation nach ICD-10-GM: B88.2 Sonstiger Befall durch Arthropoden
- System (Reich/Stamm/Klasse/Ordnung/Familie): Metazoa/Arthropoda/Arachnida/Ixodida/Ixodidae
- Artenzahl: Genus Hyalomma: 27 Arten im Jahre 2020, in Österreich kommen zwei Arten vor, von denen eine ein Irrgast ist. Im Falle der Richtigkeit einer anderen taxonomischen Ansicht kommen vier bis sechs Arten in Österreich vor.
- Charakteristik: temporärer, obligatorischer, euryxener, telmophager, ektoparasitischer Blutsauger
- Status: Erreger einer Nekrose an der Stichstelle und Vektor
- Größe: 2 bis 10 mm, Weibchen bis 25 mm
- Übertragungsart: Beim Blutsaugen mit dem Speichel
- Entwicklung: ein Larvenstadium, ein Nymphenstadium, getrenntgeschlechtliche Adulte
- Entwicklungsdauer: (Ei/Larve/Nymphe/Adulte): 21d/??d/bis ?m/bis ??
- Habitate in Österreich: Trockene und warme Orte mit Steppencharakter, Schildkrötengehege
Abb. VIII.4.1: Ein Lebensbild einer Zecke der Gattung Hyalomma.
© unbekannt.
Zecken der Gattung Hyalomma, von altgriechisch hyalos ≈ „Glas” und omma ≈ „Auge”, sind mittelgroße Tiere, die Länge variiert zwischen zwei und zehn Millimeter. Vollgesogene Weibchen erreichen auch Längen bis zu 25 mm. Die Gattung Hyalomma ist eine phylogenetisch sehr junge Gruppe der Schildzecken. Die Domestikation der Hausrinder und die Entwicklung der Viehzucht stimulierten die Evolution dieser Gruppe. Diese Entwicklung läuft auch heute noch fort, weshalb die Gattung Hyalomma ein überraschend artenarmes ⇒ Taxon innerhalb der Schildzecken ist, jedoch mit einer sehr hohen Anzahl an innerartlichen Varianten ausgestattet ist. Die Gattung ist sehr gut an eine Existenz in den ⇒ ariden ⇒ Biotopen angepasst ist, die sich rezent über weite Teile der Landfläche der Welt ausdehnen. Tiere dieser Gattung sind hochgradig adaptiert für das Leben in heißen, trockenen ⇒ Habitaten. Diese Eigenheit widerspiegelt sich in der Morphologie, zB im Besitz von gutentwickelten, kugelförmigen Augen und hohen Beinen. Die Augen befinden sich am Schildrand in kleinen Augenvertiefungen (Orbita). Der Körper ist gewöhnlich braun, nur bei einigen, wenigen Arten kommt eine farbige, ring- oder streifenförmige Pigmentierung vor. Häufig findet man Tiere mit hell geringelten oder gestreiften Beinen. Die ⇒ bifiden ⇒ Coxen des ersten Beinpaares der Adulttiere gehören zu den Gattungsmerkmalen. Wegen ihrer massiven Mundwerkzeuge werden Stiche von Hyalomma-Zecken üblicherweise als sehr schmerzhaft empfunden. Manche Bearbeiter teilen die Gattung Hyalomma in zwei Untergattungen, Hyalomma und Euhyalomma.
Verbreitung: Die Gattung kommt in der ganzen Paläoarktis, sowie in Südasien und ganz Afrika vor. Die Hauptverbreitungsgebiete sind allerdings Mittelasien und das Mittelmeergebiet. Die meisten Arten leben in Wüsten und Wüstensteppen. Sie haben unter allen Zecken den geringsten Feuchtigkeitsbedarf. Daher überleben sie sogar unter den meist ⇒ ariden Bedingungen in bewohnten Zimmern in urbanen Häusern lange, weshalb Terrarienanlagen als Quelle für Infestationen angesehen werden.
Bionomie: In der Gattung gibt es ein-, zwei- sowie drei-wirtige Zecken. Ihr Entwicklungszyklus beträgt in freier Natur normalerweise ein Jahr. Die Adulttiere schmarotzen an großen Säugern, Hyalomma aegyptium als einziger, primitiver Vertreter der Gattung an Schildkröten, wahrscheinlich nur an Schildkröten der Gattung Testudo. Die Nymphen und Larven der drei-wirtigen Arten schmarotzen an kleineren Säugern, besonders an Nagetieren.
Diese Gattung überträgt den Erreger des Mittelmeerküstenfiebers, Theileria annulata (Dschunkowsky et Luhs, 1904), das Virus des Krim-Kongo-Hämorrhagischen - der CCHF-Virus, und die Erreger des sibirischen Zeckenbissfiebers, Rickettsia conorii Brumpt, 1932, Rickettsia sibirica Zdrodovski et Golinevich, 1948 und Rickettsia australis Philip, 1950.
Genus-Synonyme sind Hyalommina Schulze, 1919; Hyalommasta Schulze, 1930; Subg. Hyalomma Tendeiro, 1962.
Unter dem Taxon Hyalomma marginatum Koch, 1844 wurden bis vor kurzem ein Komplex von vier Subspezies subsumiert:
Hyalomma marginatum marginatum Koch, 1844;
Hyalomma marginatum rufipes Koch, 1844;
Hyalomma marginatum turanicum Pomerantzev, 1946 und
Hyalomma marginatum isaaci Sharif, 1928 (cit. Horak et al. [2002]). Von diesem Komplex wurde 2006 eine gute Art geschieden, nämlich Hyalomma glabrum Delpy, 1949. Eine taxonomische Reklassifikation führte jedoch zur Wiedererrichtung der Arten Hyalomma rufipes Koch, 1844, H. turanicum Koch, 1844 und H. isaaci Sharif und damit auch von H. marginatum. cit. Apanaskevich et Horak [2008a]. Auch die Wiedererrichtung der Art H. anatolicum Koch, 1844 durch Apanaskevich et Horak [2005] erscheint mir nachvollziehbar und ich folge daher in der Abgrenzung deren Angaben. Der Leser kann aus diesen Anmerkungen ersehen, dass die Behauptung der schieren Existenz einer Art gravierende Auswirkungen auf die Faunenlisten von Gebieten, die Schädlingsbekämpfungsmaßnahmen von Ländern, die Umweltschutzpolitik von Staaten, und auf die Bestimmungsschlüssel hat.
Weltweit sind etwa 30 Hyalomma-Arten bekannt, in Europa findet man mehr oder minder regelmäßig zwei Arten, beide werden mittels Vektoren ver- und eingeschleppt. In ⇒ Zentraleuropa sind andere Hyalomma-Arten außer Hyalomma marginatum höchstwahrscheinlich nicht ⇒ autochthon. Manchmal werden Hyalomma-Larven von Vögeln aus Afrika oder aus dem Mittelmeergebiet eingeschleppt. Aber auch durch den Tiertransport von exotischen Heimtieren, besonders von Landschildkröten, werden versehentlich H. aegyptium-Zecken importiert. Derzeit kann nur ein Bestimmungsschlüssel für die Männchen wiedergegeben werden. Dieser beruht auf einem Schlüssel für die Hyalomma-Arten des Irans. cit. Hosseini-Chegeni et al. [2013].
Schlüssel zur Differenzierung der Hyalomma-Taxa „marginatum” und „aegyptium”
Bestimmungsschlüssel für die Weibchen:
Bestimmungsschlüssel für die Männchen:
VIII.4.2 Bestimmungsschlüssel der Männchen von einigen europäischen Hyalomma-Arten
cit. Hosseini-Chegeni et al. [2013] und Apanaskevich et al. [2008]
Bestimmungsschlüssel für die Männchen:
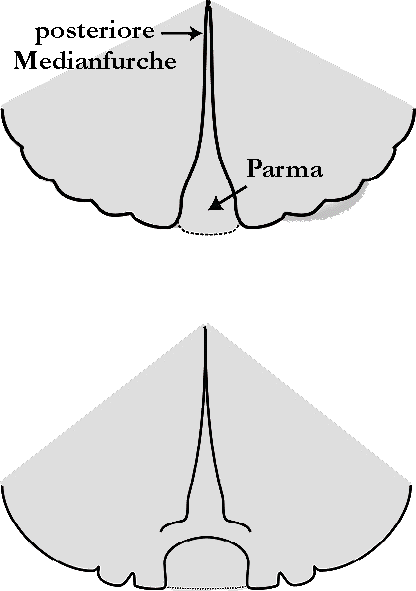
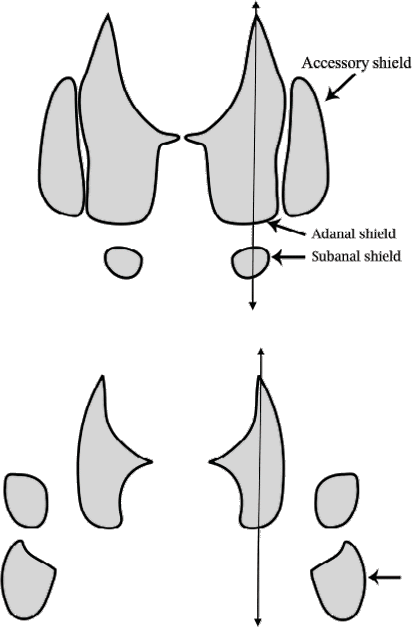
Die taxonomische Stellung der „marginatum”-Gruppe ist immer noch unklar und verwirrend. Ich teile hier die „marginatum”-Gruppe in Einzelarten auf, die etwas anders abgegrenzt werden denn oben erwähnt. Ich folge damit allerdings dem Vorschlag von Guglielmone et al. [2010]. Dann stelle ich jene beiden Formen als gute Arten dar, die in Österreich gefunden wurden. Ich bin mir aber bewusst, dass vormalige Bestimmungen dieser Tiere aus der „marginatum”-Gruppe nicht verlässlich sind. Hyalomma aegyptium wird zudem häufig nur auf Grund des Befalls eines bestimmten Wirtstieres identifiziert. Die Zweifelhaftigkeit der Artbestimmung innerhalb dieser Gattung wird allerdings bereits von Schulze [1930] im ersten Satz seiner Monographie festgestellt und beklagt. In der Einzelbeschreibung der Art Hyalomma marginatus folge ich allerdings der Arbeit von Apanaskevich et Horak [2008a], weil diese eine gute, in der Freilandakariologie anwendbare Beschreibung dieser Zecke enthält. Und kleinere Unstimmigkeiten bei der ⇒ morphologischen Artdifferenzierung in der Praxis kaum ins Gewicht fallen. In der unten stehenden Tabelle gebe ich die differenzierenden Merkmale von vier Kryptoarten der „marginatum”-Gruppe wieder, die in Europa auftreten könnten. cit. Guglielmone et al. [2009]; von Bayern et Popp [1990].
Tabelle der differenzierenden Merkmalen von vier Taxa der „marginatum”-Gruppe
| Tab. VIII.4.1: Merkmale der „marginatum”-Gruppe | |||
|---|---|---|---|
| Hyalomma marginatum | Hyalomma turanicum | Hyalomma truncatum | Hyalomma rufipes |
| Männchen | |||
| Lateralfurche undeutlich, kaudal vertieft, lang. Posteromedianfurche bis zur Scutummitte, sich kaudal verbreiternd; Paramedianfurche halb so lang | Lateralfurche flach, lang | Lateralfurche gleich tief, lang. Para- und Posteromedianfurche kaudal in der Punktierung verschwindend | Lateralfurche durch Punktierung verschwommen |
| Scutum schwarzbraun, unregelmäßig, tief, kaudal und zu den Schultern stärker punktiert; abgestumpft runder Hinterrand. Parma unauffällig, in Form und Farbe wie Festone | Scutum kaffeebraun, gleichförmig deutlich punktiert | Scutum rotschwarz, unregelmäßig, tief, kaudal stärker punktiert; sackförmiger Hinterrand | Scutum braunschwarz, dicht, gleichförmig punktiert; kreisbogenförmiger Hinterrand. Parma dreieckig, klein; Festongrenzen deutlich, tief |
| Beine gleichmäßig schwarzbraun | Beine rotbraun; Mittelglieder von III & IV mit dorsalem, hellerem Schmelz | Beine rotbraun, mit helleren Ringen | Beine rotbraun, mit helleren Ringen |
| Weibchen | |||
| Genitalöffnung länger als breit, ⇒ kaudal ⇒ konvex vorgewölbt | Genitalöffnung gleich lang wie breit | Genitalöffnung kürzer als breit; Vorderrand stärker vorgewölbt als Hinterrand | Genitalöffnung kürzer als breit; vorgewölbter Vorder- und Hinterrand |
| Scutum schwarzbraun, ⇒ median rotbraun, dicht flach punktiert | Scutum kaffeebraun, sehr dicht und zart punktiert | Scutum schwarz, wenig gleichmäßig punktiert | Scutum braunschwarz, gleichmäßig stark punktiert |
| Beine schwarzbraun, Glieder mit gelbbraunen, distalen Dorsalflecken | Beine kaffeebraun; Mittelglieder von III & IV mit hellbraunem, dorsalem Schmelz | Beine rotbraun, mit helleren Ringen | Beine rotbraun, mit helleren Ringen |
Bestimmungsschlüssel der Adulttiere von Taxa der Hyalomma marginatum-Gruppe
Bestimmungsschlüssel für die Weibchen und Männchen:
VIII.4.3 Kurzbeschreibung von in Europa nachgewiesenen Hyalomma-Arten, die aber in Zentraleuropa mit hoher Wahrscheinlichkeit nicht vorkommen
Hyalomma (Euhyalomma) excavatum Koch, 1844
Abb. VIII.4.5: Hyalomma excavatum.
© Alan R Walker (Own work) CC BY-SA 3.0 (http:// creativecommons.org/ licenses/ by-sa/3.0)], via Wikimedia Commons.
Da eine habituelle Artabgrenzung von Hyalomma excavatum umstritten ist, hier ein Bild der früheren Sammelart Hyalomma anatolicum spp. excavatum. Diese Art wurde mehrfach mit der letztgenannten Art mit oder ohne Subspezies-Status vermengt und wieder getrennt. Alle Angaben zur Bionomie sind daher sehr unsicher und müssen laufend kritisch neu bewertet werden.
Synonyme:
Hyalomma aegyptium dromedarii Neumann, 1911;
Hyalomma aegyptium typica Schulze, 1920;
Hyalomma syriacum typica Schulze, 1920;
Hyalomma anatolicum excavatum Schulze et Schlottke, 1929;
Hyalomma tunesiacum Schulze et Schlottke, 1929;
Hyalomma anatolicum zavattarii Schulze et Schlottke, 1929;
Hyalomma detritum pavlovskyi Schulze et Schlottke, 1929;
Hyalomma turkmeniense Olenev, 1931;
Hyalomma (Hyalomma) anatolicum excavatum Pomerantzev, 1946;
Hyalomma excavatum lusitanicum Stoker et Marmion, 1955.
Verbreitung: Diese Zecke gedeiht hauptsächlich im warmen, mediterranen Klima, jedoch wurde sie - falls richtig bestimmt - auch schon in Gebieten mit ausgeprägten Wintern gefunden. Unter der Annahme einer korrekten ⇒ Bestimmung lebt diese Art im südlichen Mittelmeerraum, in Albanien, Griechenland, Zypern; in Afrika in Marokko, Algerien, Libyen, Ägypten, Sudan, Dschibuti; in Asien in der Türkei, Jordanien, Libanon, Somalia, Syrien, Irak, Iran, Kasachstan, Turkmenistan, Usbekistan, Tadschikistan und Afghanistan. In Österreich wurde sie noch nie gefunden, ihre Einschleppung ist auf Grund ihrer ausgeprägten Endophilie nicht sehr wahrscheinlich.
Bionomie: Die Männchen von Hyalomma excavatum sind 3,6 bis 5,3 mal 2,2 bis 3,3 mm groß und tropfenförmig; die Weibchen erreichen nüchtern 5,0 bis 6,5 mm, vollgesogen bis 20 mm. Diese Zecken-Art ist drei-wirtig, dies ist das wesentliche Unterscheidungs- und Abgrenzungsmerkmal zu der teilweise ⇒ sympatrisch vorkommenden, zwei-wirtigen Zecke Hyalomma anatolicum Koch, 1844. Zur Bionomie ist festzustellen, dass H. anatolicum im Sinne der Sammelart als ⇒ nidikole Zecke gilt, die zudem auch noch ⇒ anthropogene, vielleicht auch ⇒ synanthrope ⇒ Habitate bevorzugt. Typischerweise leben die Adulten - und die Subadulten von Hyalomma anatolicum (s.str.) - als Stalllästling vom Blut von großen Haustieren, insbesondere Rinder, Büffel, Dromedare, Ziegen, Schafen, Pferden und Eseln. Die subadulten Hyalomma excavatum (s.str.) leben hingegen vom Blut von Kleinsäugern wie Igeln und Hasen. Hyalomma anatolicum, nun wieder im Sinne der Sammelart, befällt auch den Menschen. cit. Bursali et al. [2010] und Apanaskevich et Horak [2005].
Vektorfunktion: Diese Zecke ist ein Vektor für den Erreger des Mittelmeerküstenfiebers, Theileria annulata (Dschunkowsky et Luhs, 1904). Außerdem ist sie ein Vektor für den Erreger der bovinen Babesiose, Babesia bovis (Babés, 1888).
Hyalomma (Euhyalomma) dromedarii Koch, 1844; en: Camel Hyalomma
Abb. VIII.4.5: Hyalomma dromedarii ©: unbekannt.
Synonyme:
Ixodes camelinus Fischer von Waldheim, 1823;
Ixodes arenicola Eichwald, 1830;
Ixodes trilineatus Lucas, 1836-1844;
Ixodes cinctus Lucas, 1836-1844;
Die oben genannten Synonyme sind allesamt nomen dubium, da sie nicht den Regeln der zoologischen Nomenklatur entsprechen.
Hyalomma aegyptium dromedarii Neumann, 1901;
Hyalomma aegyptium margaropoides Sénevet, 1922;
Hyalomma aegyptium dromedarii Sharif, 1928;
Hyalomma dromedarii dromedarii Schulze et Schlottke, 1930;
Hyalomma dromedarii canariense Schulze et Schlottke, 1930;
Hyalomma yakimovi persiacum Olenev, 1931;
Hyalomma yakimovi Olenev, 1931;
Hyalomma delpyi Schulze et Gossel, 1936.
Verbreitung: Diese Zecke ist in den mediterranen Steppen und Wüsten heimisch, die nördlich des Äquators häufig sind. Man findet sie von Mauretanien bis Ägypten und in West-, Zentral- und Ost-Afrika, im Sudan, in Eritrea, Äthiopien, in Kleinasien und im Nahen Osten und in Zentral- und Südasien. Durch Viehtransporte, insbesondere Kameltransporte wird diese Zecke immer wieder nach Europa verschleppt, sie wird hier als „alien species”, aber nicht als ⇒ „invasive species” bezeichnet. In Österreich wurde sie noch nie gefunden.
Bionomie: Die Männchen von Hyalomma dromedarii sind 4,5 bis 6,5 mal 2,6 bis 4,4 mm groß und gedrungen tropfenförmig; die Weibchen erreichen nüchtern 3,6 bis 5,8 mal 1,5 bis 3,5 mm, vollgesogen 16 mal 8,4 mm. Diese Zecke durchläuft wahlweise einen Ein- oder Zwei- oder einen Drei-Wirte-Lebenszyklus. Die häufigste Form ist der Zwei-Wirte-Zyklus, der innerhalb eines Jahres durchlaufen wird. Die Larven ernähren sich von und können sich zu Nymphen häuten nach Mahlzeiten auf kleinen, grabenden Säugetieren und Hasen. Nymphen nutzen entweder die Wirte der Larven oder jene der ⇒ Adulten. Diese ernähren sich vom Blut großen Pflanzenfresser, insbesondere vom Kamel, aber auch von Rindern, Schafen, Ziegen, Pferden und Schweinen. Die Erwachsenen befallen auch den Menschen. cit. Bursali et al. [2010].
Vektorfunktion: Diese Zecke ist ein wichtiger Vektor für das Virus des Krim-Kongo-Hämorrhagischen Fiebers oder CCHF-Virus, sie überträgt aber auch den Erreger des Mittelmeerküstenfiebers, Theileria annulata (Dschunkowsky et Luhs, 1904).
Hyalomma (Hyalomma) lusitanicum Koch, 1844
Abb. VIII.4.7: Hyalomma lusitanicum.
© http://what-when-how.com/.
Synonyme:
Hyalomma aegyptium var. lusitanicum Koch, 1844 sensu Neumann 1901;
Hyalomma aegyptium lusitanicum Koch, 1844 sensu Neumann 1911;
Hyalomma lusitanicum berberum Sénevet, 1922;
Hyalomma lusitanicum lusitanicum Koch, 1844 sensu Sénevet 1928;
Hyalomma lusitanicum cicatricosum Schulze et Schlottke, 1930;
Hyalomma savignyi iberum Schulze et Schlottke, 1930;
Hyalomma iberum Schulze et Schlottke, 1930 sensu Kratz 1940;
Hyalomma excavatum lusitanicum Koch, 1844 sensu Stoker and Marmion 1955.
Verbreitung: Die Verbreitung von Hyalomma lusitanicum beschränkt sich auf den westlichen Teil des Mittelteilbereichs der Paläarktis. In Europa findet man diese Zecke in Frankreich, Italien, Portugal und Spanien, einschließlich der Kanarischen Inseln; in Afrika in Algerien und Marokko.
Bionomie: Hyalomma lusitanicum ist eine drei-wirtige Zecke. Die wichtigsten Wirte der Adulttiere sind verschiedene, große und mittlere Haustiere und Schalenwild, nämlich Rinder, Schafe, Pferde, Kamele, Ziegen, Haus- und Wildschweine, Dam- und Rotwild. Adulte wurden aber auch auf Hunden, europäischen Kaninchen, Menschen und dem Uhu saugend gefunden. Die subadulten Stadien finden sich auf dem europäischen Kaninchen, Feldhasen, Gartenschläfer, der Hausratte, dem Westeuropäischen Igel, dem Haushund, dem Rotfuchs, auf dem Wiesel und dem Europäischen Iltis.
Vektorfunktion: Es ist nahezu sicher, dass Hyalomma lusitanicum als Vektor von Theileria annulata (Dschunkowsky et Luhs, 1904 fungiert. Theileria equi (Laveran, 1901) kann zumindest im Laboratorium ihren Lebenszyklus in Hyalomma lusitanicum weiterführen. cit. Apanaskevich et al. [2008]
Hyalomma (Euhyalomma) scupense Schulze, 1919
Abb. VIII.4.8: Hyalomma scupense.
© by Lucyin (Own work) [CC BY-SA 3.0 (//creativecommons.org/ licenses/by-sa/3.0)], via Wikimedia Commons.
Diese Hyalomma-Art wurde von Schulze unter zwei verschiedenen Namen innerhalb eines Jahres beschrieben. Zur Unterscheidung diente viele Jahrzehnte lang ein ⇒ ontogenetisches Merkmal: H. scupense ist eine ein-wirtige Zecke, die Schwesterart H. detritum soll hingegen zwei-wirtig sein. Da sich die beiden Arten aber morphologisch nicht unterscheiden und wahrscheinlich ein Fall einer beliebigen Wirtigkeit vorliegt, wurden die genannten Arten 2010 zu einer Art verschmolzen, wobei die Priorität bei jenem Namen liegt, der eine Ausgabe der Zeitschrift früher genannt wurde. cit. Apanaskevich et al. [2010]. Anzumerken ist, dass genetische Untersuchungen bereits in näherer Zukunft vielleicht wiederum zum Aufsplittern der Arten führen könnten.
Synonyme:
Hyalomma (Hyalomma) detritum Schulze, 1919;
Hyalomma detritum albipictum Schulze, 1919;
Hyalomma mauritanicum Sénevet, 1922;
Hyalomma mauritanicum annulatum Sénevet, 1922;
Hyalomma detritum annulatum Sénevet, 1922 sensu Schulze, 1923;
Hyalomma mauritanicum Sénevet, 1924; nur Larve und Nymphe;
Hyalomma detritum detritum Schulze, 1919 sensu Schulze, 1927;
Hyalomma aegyptium ferozedini Sharif, 1928;
Hyalomma detritum damascenium Schulze et Schlottke, 1930;
Hyalomma detritum dardanicum Schulze et Schlottke, 1930;
Hyalomma volgense Schulze et Schlottke, 1930;
Hyalomma uralense Schulze et Schlottke, 1930;
Hyalomma detritum rubrum Schulze et Olenev in Schulze, 1930;
Hyalomma detritum mauritanicum Sénevet, 1922 sensu Schulze, 1930;
Hyalomma detritum perstrigatum Schulze, 1930;
Hyalomma verae Olenev, 1931;
Hyalomma steineri Schulze et Gossel in Schulze, 1936;
Hyalomma steineri steineri Schulze et Gossel in Schulze, 1936;
Hyalomma dardanicum Schulze et Schlottke, 1930 sensu Kaplan, 1946;
Hyalomma dardonicum Kaplan, 1946 (lapsus);
Hyalomma detritum var. scupense Schulze, 1919 sensu Delpy, 1947;
Hyalomma detritum scupense Schulze, 1919 sensu Delpy, 1949;
Hyalomma steineri enigkianum Schulze, 1950;
Hyalomma scupense detritum Schulze, 1919 sensu Feider, 1965;
Hyalomma scupense scupense Schulze, 1919 sensu Feider, 1965.
Diese Spezies ist durch eine auffällige Zeichnung der Beine gekennzeichnet. Es sind helle Längsstriche, die sich hinten dreieckig verbreitern. Das Männchen besitzt ein weißes Parma. Es handelt sich um eine mittelgroße Hyalomma-Art mit langen Mundwerkzeugen. Es ist die häufigste Rinderzecke in den subhumiden und semiariden Zonen mit einer ⇒ Abundanz von bis zu 84% auf Weiderindern.
Verbreitung: Die Art hat eines der ausgedehntesten Verbreitungsgebiete aller Schildzecken-Arten. Sie wurde in Europa in Albanien, Bosnien und Herzegowina, Bulgarien, Kroatien, Frankreich, Griechenland, Italien, Mazedonien, Moldawien, Montenegro, Rumänien, Russland, Serbien, Spanien und der Ukraine gefunden. In Asien besiedelt diese Art Afghanistan, Armenien, Aserbaidschan, China, Georgien, Indien, Iran, Irak, Israel, Jordanien, Kasachstan, Kirgisistan, Libanon, Nepal, Oman, Pakistan, Syrien, Tadschikistan, Türkei, Turkmenistan und Usbekistan. Und in Afrika wurde sie in Algerien, Ägypten, Libyen, Marokko, Sudan und Tunesien nachgewiesen. Ich glaube nicht, dass sie in Österreich heimisch ist.
Bionomie: Hyalomma scupense ist eine ein- oder zwei-wirtige Art. Sowohl die Adulten wie subadulten Stadien nutzen große und mittelgroße Huftieren als Wirte. Es wird vermutet, dass diese Art nur einjährig ist und lange auf dem Wirt sitzt. Die Larven saugen im Spätherbst, die Nymphen im Winter und die Adulten im Frühjahr. Diese Zecken wurden vor allem an domestizierten Tieren saugend gefunden, nämlich auf Rindern, Kamelen, Pferden, Eseln, Büffeln, Schafen, Ziegen und Hausschweinen. Selten wurden sie auch an Rehen, am Rothirsch und an Wildschweinen gefunden. Diese Spezies attackiert als ⇒ Adulte häufig den Menschen. cit. Bursali et al. [2010].
Vektorfunktion: Diese Zecken-Art ist ein wichtiger Vektor für Theileria annulata (Dschunkowsky et Luhs, 1904), dem Erreger des Mediterranen Küstenfiebers der Rinder. Auch dient sie als Vektor für Theileria equi (Laveran, 1901), dem Erreger der equinen Piroplasmose, für Coxiella burnetii (Derrick, 1939), dem Erreger des Q-Fiebers und für das Virus des Krimean-Kongo Hämorrhagischen Fiebers.
VIII.4.4 Einzelbeschreibung der Hyalomma-Arten, die in Zentraleuropa heimisch sind oder mit hoher Wahrscheinlichkeit vorkommen
Hyalomma marginatum Koch, 1844
Abb. VIII.4.X: Hyalomma marginatum.
Synonyme:
Acarus hispanus Fabricius, 1787 nomen dubium;
Acarus plumbeus Panzer, 1795 nomen dubium;
Ixodes hispanus (Fabricius, 1787) Latreille, 1804;
Ixodes plumbeus ( Panzer, 1795) Fabricius, 1805;
Hyalomma hispanum (Fabricius, 1787) Koch, 1844;
Hyalomma hispanicum Murray, 1877 nomen nudum, lapsus in Doss et Anastos, 1977;
Hyalomma dentatum Canestrini et Fanzago, 1878;
Phauloixodes plumbeus (Panzer, 1795) Berlese, 1889;
Phaulixodes plumbeus (Panzer, 1795) Canestrini, 1890;
Rhipicephalus plumbeus (Panzer, 1795) Neumann, 1901 nomen nudum;
Hyalomma aegyptium marginatum Koch, 1844 sensu Schulze, 1919;
Hyalomma aegyptium impressum Sénevet, 1922 nec Koch, 1844 sensu Neumann, 1901;
Hyalomma cypriacum Schulze et Schlottke, 1930;
Hyalomma marginatum balcanicum Schulze et Schlottke, 1930;
Hyalomma marginatum brionicum Schulze et Schlottke, 1930;
Hyalomma marginatum hispanum ( Fabricius, 1787) Koch, 1844 sensu Schulze et Schlottke, 1930;
Hyalomma marginatum marginatum Koch, 1844 sensu Schulze et Schlottke, 1930;
Hyalomma marginatum olenevi Schulze et Schlottke, 1930;
Hyalomma marginatum bacuense Schulze in Olenev, 1931;
Hyalomma marginatum caspium Schulze in Olenev, 1931;
Hyalomma transcaucasicum Olenev, 1934;
Hyalomma marginatum espanoli Gil Collado, 1936;
Hyalomma steineri codinai Schulze et Gossel, 1936;
Hyalomma plumbeum (Panzer, 1795) Vlasov, 1940;
Hyalomma plumbeum plumbeum (Panzer, 1795) Vlasov, 1940 sensu Pomerantzev, 1950;
Hyalomma rufipes glabratum Fonseca, Pinto, Colaco, Oliveira, Branco, da Gama, Soares Franco et Lacerda, 1951;
Hyalomma plumbeum nigricum Serdyukova, 1955;
Hyalomma rufipes glabrata Fonseca, Pinto, Colaco, Oliveira, Branco, da Gama, Soares Franco et Lacerda, 1951 sensu Hoogstraal, 1956.
Die gegenwärtige Zusammensetzung der „marginatum”-Gruppe umfasst folgende Taxa:
H. marginatum Koch, 1844; + H. rufipes Koch, 1844; + H. isaaci Sharif, 1928; + H. turanicum Pomerantzev, 1946; + H. glabrum Delpy, 1949.
cit. Apanaskevich et Horak [2008a].
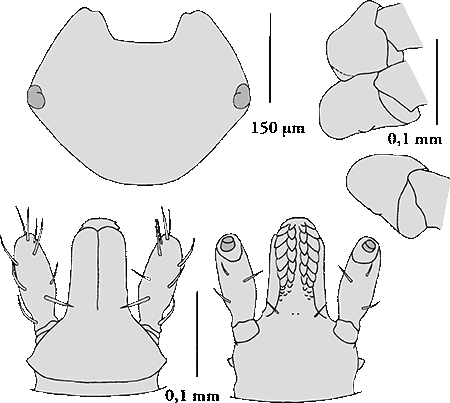
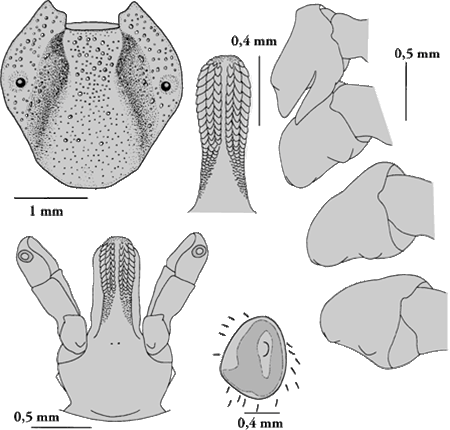 Weibchen: Die weiblichen Adulttiere sind 5,0 bis 6,5 mm lang. Dorsalseite: Auf dem Schild fehlt eine fahle Marmorierung. Dieses ist fast so lang wie breit, die postero--lateralen Ecken sind sehr stark ausgeprägt. Die Cervical- und die Lateralfurchen sind mäßig tief und verlaufen bis zum Hinterrand des Scutums. Dorsal gesehen erscheinen die seitlichen Vorsprünge der ⇒ Basis capituli kurz, von ventral gesehen fehlen sie. Der postero-dorsale Rand der Basis capituli ist gerade oder leicht ⇒ konkav; die ⇒ Cornua sind unauffällig. Die Palpen der Weibchen sind wesentlich länger als die Basis capituli. Ihr zweites Glied ist gedrungen. Ihr Außenrand ist gerade oder etwas gewölbt. Das Segment I der Palpen trägt mehr als fünf ventromediane Borstenhaare (⇒ Setae). Das ⇒ Hypostom ist keulenförmig. Die ⇒ Coxen des ersten Beinpaares enden in zwei Spitzen. Sie stehen eng beieinander. Diese Innen- und Außendornen an der Coxa I sind lang, entweder gleichlang oder der äußere Dorn ist leicht länger als der innere. Die Außendornen der Coxen II bis IV sind gut entwickelt, breit dreieckig, der Innendorn der Coxen II und III ist undeutlich erkennbar, im Großen und Ganzen bogenförmig, der Innendorn der Coxa IV ist deutlich erkennbar und breit dreieckig im Umriss.
Weibchen: Die weiblichen Adulttiere sind 5,0 bis 6,5 mm lang. Dorsalseite: Auf dem Schild fehlt eine fahle Marmorierung. Dieses ist fast so lang wie breit, die postero--lateralen Ecken sind sehr stark ausgeprägt. Die Cervical- und die Lateralfurchen sind mäßig tief und verlaufen bis zum Hinterrand des Scutums. Dorsal gesehen erscheinen die seitlichen Vorsprünge der ⇒ Basis capituli kurz, von ventral gesehen fehlen sie. Der postero-dorsale Rand der Basis capituli ist gerade oder leicht ⇒ konkav; die ⇒ Cornua sind unauffällig. Die Palpen der Weibchen sind wesentlich länger als die Basis capituli. Ihr zweites Glied ist gedrungen. Ihr Außenrand ist gerade oder etwas gewölbt. Das Segment I der Palpen trägt mehr als fünf ventromediane Borstenhaare (⇒ Setae). Das ⇒ Hypostom ist keulenförmig. Die ⇒ Coxen des ersten Beinpaares enden in zwei Spitzen. Sie stehen eng beieinander. Diese Innen- und Außendornen an der Coxa I sind lang, entweder gleichlang oder der äußere Dorn ist leicht länger als der innere. Die Außendornen der Coxen II bis IV sind gut entwickelt, breit dreieckig, der Innendorn der Coxen II und III ist undeutlich erkennbar, im Großen und Ganzen bogenförmig, der Innendorn der Coxa IV ist deutlich erkennbar und breit dreieckig im Umriss.
Ventralseite: Die Genitalöffnung ist breit, flach, abgerundet und U-förmig. Der vestibuläre Teil der Vagina ist mäßig gewölbt. Die präatriale Falte ist subzirkular und erscheint prall über ihre ganze Länge. Die Coxen des ersten Beinpaares enden in zwei Spitzen. Der gezahnte Teil des Hypostoms ist etwas länger als der unbezahnte. Die Zahnformel lautet 3-3 in 12 bis 13 Querreihen.
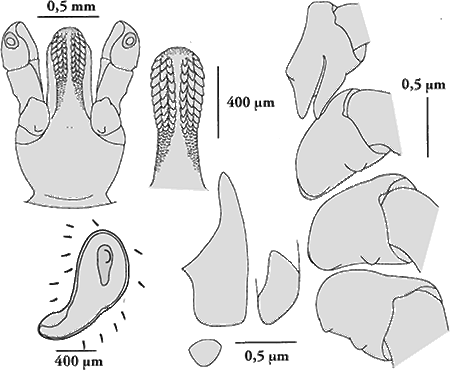 Männchen: Die männlichen Adulttiere sind 3,8 bis 4,5 mm lang. Das ⇒ Conscutum ist eiförmig, langgestreckt und hat eine leichte Einengung im Bereich des Spiracularplatten. Es trägt 5 Festone aber kein Parma. Eine fahle Marmorierung fehlt. Die Cervical- und die Lateralfurchen sind flach und bis zu ⅓ der Länge des Conscutums lang. Die Marginalfurchen sind lang und erreichten fast die Augen. Die Farbe des Conscutums ist dunkel, von rot über braun bis fast schwarz. Große Punktierung ist selten; kleine und mittlere Punktierung bedeckt die seitlichen und vorderen Teile der zentralen Felder, besonders dicht ist die Punktierung am Schwanzfeld. Die Mitte des Conscutums ist in der Regel glatt, ohne offensichtliche Punktierung. Die ⇒ Basis capituli trägt keine seitliche Vorsprünge, ihr dorsaler, hinterer Rand ist ⇒ konkav gekrümmt, die ⇒ Cornua sind bescheiden. Das Segment I der Palpen trägt mehr als fünf ventromediane Setae. Das ⇒ Hypostom ist keulenförmig. Die ⇒ Coxen des ersten Beinpaares enden in zwei Spitzen. Sie stehen eng beieinander. Diese Innen- und Außendornen an der Coxa I sind lang, entweder gleichlang oder der äußere Dorn ist leicht länger als der innere. Die Außendornen an den Coxen II bis IV sind deutlich ausgeprägt, dreieckig; der Innendorn der Coxa II und III ist undeutlich, im Großen und Ganzen bogenförmig; der Innendorn der Coxa IV ist wiederum deutlich ausgeprägt, dreieckig. Dorsal gelegene, elfenbeinfarbene Streifen an jedem Segment der Beine, insbesondere stark ausgeprägt an den Hinterbeinen.
Männchen: Die männlichen Adulttiere sind 3,8 bis 4,5 mm lang. Das ⇒ Conscutum ist eiförmig, langgestreckt und hat eine leichte Einengung im Bereich des Spiracularplatten. Es trägt 5 Festone aber kein Parma. Eine fahle Marmorierung fehlt. Die Cervical- und die Lateralfurchen sind flach und bis zu ⅓ der Länge des Conscutums lang. Die Marginalfurchen sind lang und erreichten fast die Augen. Die Farbe des Conscutums ist dunkel, von rot über braun bis fast schwarz. Große Punktierung ist selten; kleine und mittlere Punktierung bedeckt die seitlichen und vorderen Teile der zentralen Felder, besonders dicht ist die Punktierung am Schwanzfeld. Die Mitte des Conscutums ist in der Regel glatt, ohne offensichtliche Punktierung. Die ⇒ Basis capituli trägt keine seitliche Vorsprünge, ihr dorsaler, hinterer Rand ist ⇒ konkav gekrümmt, die ⇒ Cornua sind bescheiden. Das Segment I der Palpen trägt mehr als fünf ventromediane Setae. Das ⇒ Hypostom ist keulenförmig. Die ⇒ Coxen des ersten Beinpaares enden in zwei Spitzen. Sie stehen eng beieinander. Diese Innen- und Außendornen an der Coxa I sind lang, entweder gleichlang oder der äußere Dorn ist leicht länger als der innere. Die Außendornen an den Coxen II bis IV sind deutlich ausgeprägt, dreieckig; der Innendorn der Coxa II und III ist undeutlich, im Großen und Ganzen bogenförmig; der Innendorn der Coxa IV ist wiederum deutlich ausgeprägt, dreieckig. Dorsal gelegene, elfenbeinfarbene Streifen an jedem Segment der Beine, insbesondere stark ausgeprägt an den Hinterbeinen.
Ventral finden sich drei Paar Analplatten. Die Spiracularplatte ist kommaförmig. Die dorsale Verlängerung dieser Platte ist lang und deutlich unterscheidbar vom Körper der Platte. Der perforierte Abschnitt der zum Rücken ragenden Verlängerung ist gerade und an der Spitze geschwungen. Die Anzahl der zirkumspirakulären Seten ist spärlich. Das ⇒ Hypostom ist keulenförmig; der gezahnte Teil ist etwas länger als der zahnfreie. Die Zahnformel lautet 3-3 in 10 Querreihen.
 Nymphe: Das ⇒ Capitulum der Nymphe ist dreieckig. ⇒ Basis capituli ist von dorsal gesehen hexagonal. Das zweite Segment der Palpen ist ⇒ proximal schmaler und erweitert sich nach distal nach und nach. Das ⇒ Hypostom ist keulenförmig, der Übergang des gezahnten Abschnitts zum zahnlosen ist glatt. Der zahnlose Teil ist mehr als doppelt so lang wie der zahnlose Teil. Die Dornen an den ⇒ Coxa I sind lang, etwa gleich lang und subtriangular im Umriss. Die Dornen an der Coxen II bis IV sind groß, mehr oder minder gleich groß, leicht abnehmend in der Größe von Coxa II zur Coxa IV. Coxalporen fehlen. Die Zahnformel ist von ⇒ apikal 1',1-1,1' und dann 2-2 in 8 Querreihen.
Nymphe: Das ⇒ Capitulum der Nymphe ist dreieckig. ⇒ Basis capituli ist von dorsal gesehen hexagonal. Das zweite Segment der Palpen ist ⇒ proximal schmaler und erweitert sich nach distal nach und nach. Das ⇒ Hypostom ist keulenförmig, der Übergang des gezahnten Abschnitts zum zahnlosen ist glatt. Der zahnlose Teil ist mehr als doppelt so lang wie der zahnlose Teil. Die Dornen an den ⇒ Coxa I sind lang, etwa gleich lang und subtriangular im Umriss. Die Dornen an der Coxen II bis IV sind groß, mehr oder minder gleich groß, leicht abnehmend in der Größe von Coxa II zur Coxa IV. Coxalporen fehlen. Die Zahnformel ist von ⇒ apikal 1',1-1,1' und dann 2-2 in 8 Querreihen.
 Larve: Der Teil des Scutums hinter den Augen ist nahezu gleich der Hälfte der Schildlänge. Der Schildhinterrand ist breit gerundeten oder leicht ⇒ konvex gekrümmt. Die postero--lateralen Ränder des Schildes sind fast gerade, ohne Einbuchtungen. Die ⇒ Basis capituli ist dorsal gesehen hexagonal. Die Spitzen der seitlichen Vorsprünge sind nach der Seite oder leicht nach vorn gerichtet. Von ventral gesehen erscheinen die seitlichen Vorsprünge deutlich ventral und erstrecken sich geringfügig über den Seitenrand. Am ⇒ Hypostom ist der Übergang des gezahnten Abschnitts zum zahnfreien Abschnitt glatt; der gezahnte Abschnitt ist etwa ⅔ so lang wie das ganze Hypostom. Die Zahnformel lautet 2-2 in 6 bis 7 Querreihen.
Larve: Der Teil des Scutums hinter den Augen ist nahezu gleich der Hälfte der Schildlänge. Der Schildhinterrand ist breit gerundeten oder leicht ⇒ konvex gekrümmt. Die postero--lateralen Ränder des Schildes sind fast gerade, ohne Einbuchtungen. Die ⇒ Basis capituli ist dorsal gesehen hexagonal. Die Spitzen der seitlichen Vorsprünge sind nach der Seite oder leicht nach vorn gerichtet. Von ventral gesehen erscheinen die seitlichen Vorsprünge deutlich ventral und erstrecken sich geringfügig über den Seitenrand. Am ⇒ Hypostom ist der Übergang des gezahnten Abschnitts zum zahnfreien Abschnitt glatt; der gezahnte Abschnitt ist etwa ⅔ so lang wie das ganze Hypostom. Die Zahnformel lautet 2-2 in 6 bis 7 Querreihen.
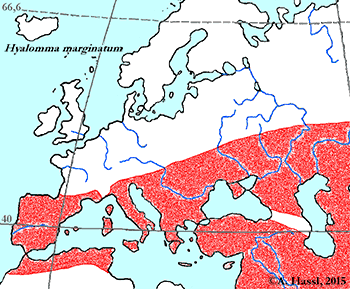 Verbreitung: Diese Zecke ist ein mediterranes Faunenelement und eine klassische Schildzeckenart Süd- und Osteuropas (Albanien, Bosnien und die Herzegowina, Bulgarien, Kroatien, Zypern, Frankreich, Griechenland, Italien, Mazedonien, Moldawien, Montenegro, Portugal, Rumänien, Russland, Serbien, Spanien, Ungarn, Ukraine), Südwestasiens (Armenien, Azerbaijan, Georgien, Iran, Irak, Israel, Syrien, Türkei und Turkmenistan) und Nordafrikas (Algerien, Ägypten, Libyen, Marokko und Tunesien). cit. Apanaskevich et Horak [2008a], Hornok et Horváth [2012]. Im nördlichen Mittelmeerraum und in Teilen Südeuropas ist sie häufig anzutreffen, verschleppt wurde sie bis nach Böhmen und Süddeutschland. Das Fehlen eines Nachweises in Österreich scheint eher dem mangelnden Bewusstsein über die Existenz dieser eindrucksvollen Zecke hierzulande zuzuschreiben zu sein, denn auf ein tatsächliches Fehlen dieser Zecken-Art in den mediterran beeinflussten Gebieten Österreichs. Einige Beobachtungen aus Nordwesteuropa und Nigeria beziehen sich auf Larven und Nymphen, die offensichtlich von Zugvögeln verschleppt werden, sich aber nicht über ungünstige Jahreszeiten halten können.
Verbreitung: Diese Zecke ist ein mediterranes Faunenelement und eine klassische Schildzeckenart Süd- und Osteuropas (Albanien, Bosnien und die Herzegowina, Bulgarien, Kroatien, Zypern, Frankreich, Griechenland, Italien, Mazedonien, Moldawien, Montenegro, Portugal, Rumänien, Russland, Serbien, Spanien, Ungarn, Ukraine), Südwestasiens (Armenien, Azerbaijan, Georgien, Iran, Irak, Israel, Syrien, Türkei und Turkmenistan) und Nordafrikas (Algerien, Ägypten, Libyen, Marokko und Tunesien). cit. Apanaskevich et Horak [2008a], Hornok et Horváth [2012]. Im nördlichen Mittelmeerraum und in Teilen Südeuropas ist sie häufig anzutreffen, verschleppt wurde sie bis nach Böhmen und Süddeutschland. Das Fehlen eines Nachweises in Österreich scheint eher dem mangelnden Bewusstsein über die Existenz dieser eindrucksvollen Zecke hierzulande zuzuschreiben zu sein, denn auf ein tatsächliches Fehlen dieser Zecken-Art in den mediterran beeinflussten Gebieten Österreichs. Einige Beobachtungen aus Nordwesteuropa und Nigeria beziehen sich auf Larven und Nymphen, die offensichtlich von Zugvögeln verschleppt werden, sich aber nicht über ungünstige Jahreszeiten halten können.
Bionomie: Hyalomma marginatum ist die einzige zwei-wirtige Zecke ⇒ ⇒ Zentraleuropas und eine ⇒ ditropische Zecke. Sie bevorzugt Vögel als Blutspender und Verschlepper in den subadulten Stadien und Großsäuger im Adultstadium. Zudem kann sie zwei, sich im Überwinterungsstadium unterscheidende, alternative Entwicklungswege einschlagen: Die nüchternen Larven attackieren einen passenden Wirt, sie saugen Blut, die vollgesogenen Larven bleiben am Wirt, sie häuten sich dort und saugen ein weiteres Mal Blut, nun als Nymphe. Dieser Vorgang dauert 12 bis 26 Tage. An diesem Punkt in der Individualentwicklung teilt sich nun die weitere Ontogenie in zwei alternative Wege:
Weg 1: Haben die Nymphen im Frühsommer Blut gesogen, verlassen sie gleich nach der Mahlzeit den Wirt, häuten sich unmittelbar danach, und überwintern nun als Adulttiere. Dies ist der häufiger beschrittene Weg.
Weg 2: Jene Nymphen, die erst im Spätsommer zu ihrer Blutmahlzeit gekommen sind, verlassen den Wirt im September oder Oktober und überwintern als Nymphen. Sie häuten sich zu den Adulttieren erst im folgenden Frühjahr. Es ist unklar, ob diese Zecke eine ⇒ Diapause, meist wohl in Form der Überwinterung, benötigt, oder ob der gesamte Generationszyklus in einem Jahr, mit oder ohne Diapause der Adulttiere, absolviert werden kann. Die Adulttiere suchen sich jedenfalls immer im Frühjahr einen neuen Wirt, an dem sie Blut saugen. Die vollgesogenen Weibchen fallen danach vom Wirt ab und legen einmalig bis zu 7 000 Eier in die oberen Bodenschichten. Danach sterben sie. Die Larven schlüpfen nach 20 bis 40 Tagen. Im Laboratorium dauert der gesamte Lebenszyklus zumindest 14 Wochen. Alle Stadien sind in den Sommermonaten am aktivsten. Die Larven und Nymphen findet man herumkriechend insbesondere zwischen Juni und Oktober mit einem Maximum an Aktivität im Juli und August. Individuen dieser Art können angeblich unter Laborbedingungen bis zu 800 Tage ohne Blutmahlzeit überleben.
Diese Art ist ein aktiver Jäger, der Wirtsindividuen auf 3 bis 4 Meter Entfernung anläuft und bis zu 9 Meter Entfernung optisch ausmachen und erkennen kann. Sie tritt in unterschiedlichen ⇒ Biotopen auf, die sich alle durch eine geringe Luftfeuchtigkeit auszeichnen, wie Steppen, Savannen und schütter bewaldete Berge. Diese zwei-wirtige Zecken-Art bevorzugt als ersten Wirt angeblich Hasen, Igel, Eidechsen und unter den Vögeln insbesondere den Eichelhäher. Eichelhäher sind in ⇒ Zentraleuropa Dispersions- und Teilzieher, wobei regelmäßig Einzelvögel in südwestlicher Richtung bis zu 100 Kilometer wegziehen. Der zweite Wirt werden große Säugetiere, insbesondere Haus- und Nutztiere, gelegentlich auch Menschen genannt. cit. Estrada-Peña et Jongejan [1999]. Bemerkenswerterweise werden extrem selten Rehe als Wirte aufgezählt. Nach den Angaben der Autoren von Bayern et Popp [1990] waren auf der Krim Weibchen am häufigsten auf Rindern und Rotwild, Männchen auf Rindern und Schweinen zu finden; Larven fanden sich besonders auf Eichelhähern und Haushühnern, Nymphen auf Hasen und Eichelhähern. Es ist die einzige zwei-wirtige Schildzeckenart, die in Zentraleuropa vorkommt - ob sie allerdings auch ⇒ autochthon ist, ist strittig. Falls sie in Österreich in den nächsten Jahren gefunden werden sollte, halte ich diese Art für einen aus dem Mediterranraum stammenden Gast. Andere Experten meinen, dass es sich bereits um ein ⇒ allochthones ⇒ Neozoon handelt. Da die Larven und die Nymphen Blut saugen ohne den Wirt zum Zwecke der Häutung zu verlassen, verbringen Zeit genug auf ihm, um passiv durch den Vogelzug auch über große Entfernungen verschleppt zu werden. Allerdings sind Funde auf Zugvögel selten oder zumindest nicht ausreichend dokumentiert. In Spanien wurden die ersten subadulten Zecken auf Standvögeln im Mai und Juni gefunden, was viel zu spät im Jahreslauf ist, um noch verschleppt zu werden. Dies kann daran liegen, dass die Zecke im Mittelmeerraum zur Zeit des Frühjahrszuges, im März, noch nicht aktiv genug ist, um kurzzeitig rastende Vögel zu befallen. Die Funde ⇒ adulter Zecken dieser Art nördlich des Mittelmeerraumes sind bemerkenswert selten.
Wirte: Diese Zecken-Art ist wenig wirtsspezifisch, jedoch in ihren Jugendstadien mit einer Vorliebe für Eichelhäher ausgestattet. Angeblich befallen die Weibchen sogar Landschildkröten, speziell die Maurische Landschildkröte Testudo graeca Linnaeus, 1758. cit. Zlatanova [1991]. Ich denke allerdings, dass bei der Erstellung dieses Befunds entweder eine Verwechslung der Zecken-Art passierte oder der Fund ein Ausdruck eines artifiziellen Szenarios ist, obgleich es sich um eine sehr aggressive Zecke mit einem breiten Wirtsspektrum handelt.

- Heimische Wirte der Larven:
- Passeriformes: Garrulus glandarius (Linnaeus, 1758) dt: Eichelhäher;
- Motacilla flava (Linnaeus, 1758) dt: Schafstelze cit. Siuda et al. [2006]).
- Galliformes: Gallus gallus domesticus (Linnaeus, 1758) dt: Haushuhn.
- Heimische Wirte der Nymphen:
- Lagomorpha: Lepus europaeus Pallas, 1778 dt: Feldhase.
- Passeriformes: Garrulus glandarius (Linnaeus, 1758) dt: Eichelhäher.
- Heimische Wirte der Adulttiere:
- Artiodactyla: Bos primigenius taurus Linnaeus, 1758 dt: Hausrind;
- Cervus elaphus Linnaeus, 1758 dt: Rothirsch;
- Capreolus capreolus (Linnaeus, 1758) dt: Reh;
- Sus scrofa domestica Linnaeus, 1758 dt: Hausschwein;
- Testudinata: Testudo graeca Linnaeus, 1758 dt Maurische Landschildkröte.
- Heimische Wirte ohne Stadiendifferenzierung:
- Primates: Homo sapiens Linnaeus, 1758 dt: Mensch.
- Artiodactyla: Bubalus arnee (Kerr, 1792) dt: Wasserbüffel;
- Bos primigenius taurus Linnaeus, 1758 dt: Hausrind;
- Sus scrofa Linnaeus, 1758 dt: Wildschwein;
- Capra aegagrus hircus Erxleben, 1777 dt: Hausziege;
- Ovis orientalis aries Linnaeus, 1758 dt: Hausschaf.
- Carnivora: Canis lupus familiaris (Linnaeus, 1758) dt: Haushund;
- Felis silvestris catus (Linnaeus, 1758) dt: Hauskatze;
- Martes foina (Erxleben, 1777) dt: Steinmarder.
- Perissodactyla: Equus asinus asinus Linnaeus, 1758 dt: Esel;
- Equus ferus caballus Linnaeus, 1758 dt: Hauspferd.
- Passeriformes: Burhinus oedicnemus Linnaeus, dt: Triel;
- Anthus trivialis Linnaeus, 1758 dt: Baumpieper;
- Oriolus oriolus(Linnaeus, 1758) dt: Pirol;
- Galerida cristata (Linnaeus, 1758) dt: Haubenlerche;
- Phoenicurus phoenicurus (Linnaeus, 1758) dt: Gartenrotschwanz;
- Monticola saxatilis (Linnaeus, 1766) dt: Steinrötel;
- Luscinia megarhynchos Brehm, 1831 dt: Nachtigall;
- Motacilla cinerea Tunstall, 1771 dt: Gebirgsstelze;
- Oriolus oriolus (Linnaeus, 1758) dt: Pirol;
- Muscicapa striata (Pallas, 1764) dt: Grauschnäpper.
- Galliformes: Coturnix coturnix Linnaeus, 1758 dt: Wachtel.
- Coraciiformes: Coracias garrulus (Linnaeus, 1758) dt: Blauracke.
- Bucerotiformes: Upupa epops Linnaeus, dt: Wiedehopf.
Vektorfunktion: Diese Zecken-Art ist der bedeutendste Vektor für das CCHF-Virus, dem Erreger des Krim-Kongo-Hämorrhagischen Fiebers, sie überträgt aber auch auf Hunde Babesia canis (Piana et Galli-Valerio 1895), auf Rinder Babesia ovis (Babès 1888), auf Pferde Babesia caballi (Nuttall et Strickland, 1910) und Theileria equi (Laveran, 1901). Natürliche Infektionen der Zecken mit Coxiella burnetii (Derrick, 1939), dem Erreger des Q-Fiebers, und Rickettsia aeschlimannii Beati, Meskini, Thiers & Raoult 1997, einem humanpathogenen spotted-fever-group-Erreger wurden beobachtet. cit. Beati et al. [1997]; Pretorius et Birtles [2002].
Hyalomma aegyptium (Linnaeus, 1758)
dt: Schildkrötenzecke, en: Tortoise tick, Bont leg tick, Tortoise Hyalomma
Abb. VIII.4.X: Hyalomma aegyptium ♂.
Hyalomma aegyptium ist eine Zecken-Art, die als ⇒ stenophag, also als sehr streng wirtspezifisch gilt. Dabei ist aber unklar, ob die Maurischen Landschildkröte, Testudo graeca, der offensichtliche Hauptwirt der Zecke, tatsächlich auch der unter natürlichen Bedingungen einzige effektive Wirt ist. Die publizierten Daten zur Verbreitung der Maurischen Landschildkröte sind selbst in Europa, zB am Balkan, so unpräzise und so widersprüchlich, dass die These der Monophagie dieser Zecke mit ihnen weder gestützt noch widerlegt werden kann. Es ist nach meiner Meinung anzunehmen, dass lokal auch andere Mediterrane Landschildkröten als Blutspender genutzt werden, wobei die Frage der Bekömmlichkeit der Blutmahlzeit an diesen Wirtstieren unbeantwortet bleibt. Die Diagnose Hyalomma aegyptium wird häufig auf Grund der postulierten Wirtsspezifität gestellt. Deswegen existiert auch kein zuverlässiger Bestimmungsschlüssel. Zecken, die von mediterranen Landschildkröten aus dem Freiland oder von frisch importierten Landschildkröten stammen, lassen sich leicht in die europäischen Zeckengattungen einordnen. Hyalomma-Zecken von Schildkröten werden dann häufig der Art Hyalomma aegyptium zugeordnet, wobei es sich bei dieser Art sogar um eine Sammel-Art handeln könnte. Diese Zecken-Art ist in Österreich nicht heimisch. Sie könnte sich aber wegen der lokal dichten Landschildkrötenbestände dauerhaft ansiedeln, obgleich durch die EU-Artenschutzgesetzgebung der unkontrollierte und massenhafte Import von Landschildkröten weitgehend unterbunden wurde.
Synonyme:
Acarus aegyptius Linneaus, 1758;
Hyalomma aegyptium syriacum (Linnaeus, 1758); unklare Priorität und Nomenklatur.
Hyalomma aegyptius (Linnaeus, 1758);
Cynorhaestes aegyptius (Linnaeus, 1758);
Ixodes aegyptius (Linnaeus, 1758);
Acarus testudinis Hasselquist, 1762;
Hyalomma syriacum Koch, 1844;
Ixodes testudinis Leydig, 1855;
Ixodes cornuger Kolenati, 1857;
Hyalomma cornuger Murray, 1877;
Hyalomma affine Neumann, 1899;
Amblyomma (sic!) aegyptium Rickman, 1908;
Hyalomma syriacum punctata Schulze, 1919;
Hyalomma aegyptium punctata Schulze, 1919;
Hyalomma syriacum Sharif, 1928;
Hyalomma aegypticum Jaschke, 1933;
Hyalomma aegyptium syriacum Oswald, 1941;
Hyalomma testudinis Buitendijk, 1945.
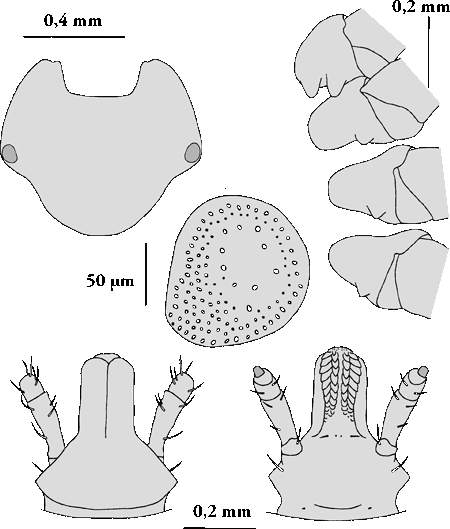
 Weibchen: Die Länge der nüchternen Weibchen beträgt 5,5 bis 6,5 mm, die vollgesogener Weibchen bis 20 mm. Dorsalseite: Die Augen liegen knapp vor der breitesten Stelle des Schildes. Die Borstenhaare (⇒ Setae) am ⇒ Alloscutum sind normalerweise wie Stöcke geformt, sie verjüngen sich gegen die Spitze. Die ⇒ Areae porosae sind klein. Die ⇒ Cornua sind klein, gering ausgebildet. Das zweite Palpensegment ist mit einer ⇒ proximalen Verengung versehen.
Weibchen: Die Länge der nüchternen Weibchen beträgt 5,5 bis 6,5 mm, die vollgesogener Weibchen bis 20 mm. Dorsalseite: Die Augen liegen knapp vor der breitesten Stelle des Schildes. Die Borstenhaare (⇒ Setae) am ⇒ Alloscutum sind normalerweise wie Stöcke geformt, sie verjüngen sich gegen die Spitze. Die ⇒ Areae porosae sind klein. Die ⇒ Cornua sind klein, gering ausgebildet. Das zweite Palpensegment ist mit einer ⇒ proximalen Verengung versehen.
Ventralseite: Die ⇒ Coxa I trägt je einen breiten, dreieckigen und mehr oder minder gleich in der Größe ausgebildeten Innen- und Außendornen. Die Dornen sind breit separiert. Auf den ⇒ Auriculae sitzt ein Dorn. Die Genitalöffnung erscheint als weiter Bogen mit einem geraden ⇒ posterioren Rand. cit. Apanaskevich [2003]. Das ⇒ Hypostom ist streitkolbenförmig, ⇒ apikal aufgetrieben. Der Apex ist leicht eingezogen, zwischen den Zahnzeilen verläuft ein Spalt. An der Spitze stehen ungeordnet zahlreiche kleine dreieckige Zähnchen, ⇒ proximal stehen sie dann geordnet. Die Zahnformel lautet: 6 Querreihen zu je 3-3.

 Männchen: Die Länge der Männchen beträgt 3,8 bis 5,6 mm. Dorsalseite: Die Augen liegen in Gruben am Schild, nicht am Schildrand. Am Scutum befinden sich keinerlei Furchen außer zweier kurzer, Graben-artiger Cervikalfurchen. Die Punktierung des Schildes ist schütter, aber eindrucksvoll. Die ⇒ Cornua an der ⇒ Basis capituli sind deutlich ausgeprägt.
Männchen: Die Länge der Männchen beträgt 3,8 bis 5,6 mm. Dorsalseite: Die Augen liegen in Gruben am Schild, nicht am Schildrand. Am Scutum befinden sich keinerlei Furchen außer zweier kurzer, Graben-artiger Cervikalfurchen. Die Punktierung des Schildes ist schütter, aber eindrucksvoll. Die ⇒ Cornua an der ⇒ Basis capituli sind deutlich ausgeprägt.
Ventralseite: Die Adenalschilde sind kurz und breit, ohne inneren Ast, der ⇒ posteriore Teil ist erweitert, der anteromediane Rand ist gerade. Auf der ⇒ Coxa I sitzen je ein breiter, dreieckiger, mehr oder minder gleich in der Größe ausgebildeten Innen- und Außendorn. Diese sind weit separiert. Der Außendorn ist spitzer als jener der Weibchen. Auf den ⇒ Auriculae sitzen nach hinten gerichtete Dornen. Die Ventralplatten sind stark sklerotisiert. cit. Apanaskevich [2003]. Das ⇒ Hypostom ist von ventral betrachtet kolbenförmig. Der Apex ist leicht eingezogen, zwischen den Zahnzeilen verläuft ein Spalt. Vom Apex weg geordnet, 2 Querreihen 2-2, danach 6 Querreihen zu je 3-3. Die Zahnfelder münden in zwei seitliche, spitze Areale mit winzigen - chen ein.
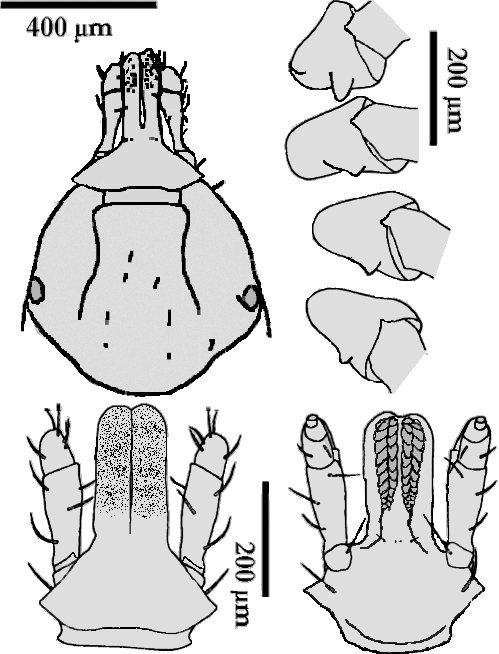 Nymphe: Die Länge der nüchternen Nymphe beträgt 1,4 bis 1,8 mm. Die postero-medianen Setae am Scutum sind normalerweise wie Stöcke geformt und tragen eine eingekerbte Spitze. Die Dornen auf der ⇒ Coxa I sind groß, der innere Dorn ist gleichseitig dreieckig und kürzer als der äußere. Die Dornen auf den Coxen II bis IV sind gut ausgebildet und haben spitze Apices. cit. Apanaskevich [2003]. Die Spirakularplatte ist beinahe kreisrund. Das Hypostom ist, von ventral gesehen, zapfenförmig, ⇒ apikal breiter, Apex ganz leicht eingesenkt, mit schmalem Spalt ⇒ median zwischen den Reihen, Zahnformel: 8 Zeilen zu je 2-2.
Nymphe: Die Länge der nüchternen Nymphe beträgt 1,4 bis 1,8 mm. Die postero-medianen Setae am Scutum sind normalerweise wie Stöcke geformt und tragen eine eingekerbte Spitze. Die Dornen auf der ⇒ Coxa I sind groß, der innere Dorn ist gleichseitig dreieckig und kürzer als der äußere. Die Dornen auf den Coxen II bis IV sind gut ausgebildet und haben spitze Apices. cit. Apanaskevich [2003]. Die Spirakularplatte ist beinahe kreisrund. Das Hypostom ist, von ventral gesehen, zapfenförmig, ⇒ apikal breiter, Apex ganz leicht eingesenkt, mit schmalem Spalt ⇒ median zwischen den Reihen, Zahnformel: 8 Zeilen zu je 2-2.
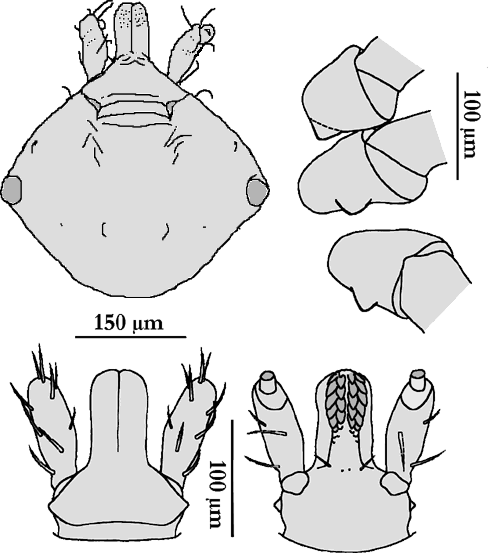 Larve: Dorsalseite: Das Scutum ist 240 bis 280 μm lang. Der ⇒ posteriore Teil des Scutums, jener hinter den Augen, ist deutlich verlängert. Die postero--lateralen Einschnitte sind nur schwach entwickelt. Das Verhältnis Länge:Breite beträgt 0,75 bis 0,85.
Larve: Dorsalseite: Das Scutum ist 240 bis 280 μm lang. Der ⇒ posteriore Teil des Scutums, jener hinter den Augen, ist deutlich verlängert. Die postero--lateralen Einschnitte sind nur schwach entwickelt. Das Verhältnis Länge:Breite beträgt 0,75 bis 0,85.
Ventralseite: Die Dornen auf der Coxa I sind gleichseitig dreieckig im Umriss mit abgerundeten Spitzen. Die Dornen auf den Coxen II und III sind sehr groß. cit. Apanaskevich [2003]. Das ⇒ Hypostom ist kolbenförmig, die Zahnformel lautet 2-2 in 6 Reihen.
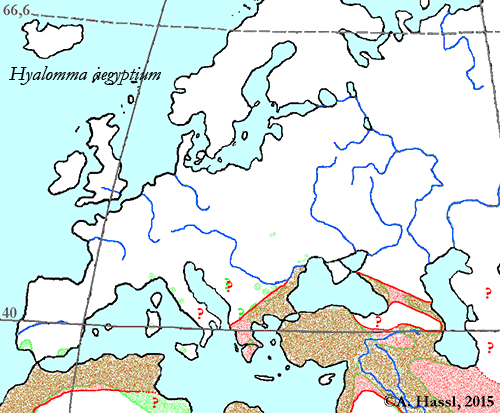 Verbreitung: Bedingt durch die von mir vermuteten häufigen Fehlbestimmungen sind die Daten zur Verbreitung dieser Zecke wenig gesichert. In ihrem Verbreitungsgebiet, das von Marokko über den Nahen Osten bis in den Iran, Kirgisistan und Tadschikistan reicht, tritt diese Art offensichtlich nirgends ⇒ ubiquitär auf. Ich meine, dass diese Beobachtung auf die von mir angenommene, hohe Wirtsspezifität dieser Zecke zurückzuführen ist. Die hier präsentierte Verbreitungskarte dieser Zecken-Art im europäisch-mediterranen Bereich wurde aus Daten von Gemel et Hörweg [2011], Hassl [2003], Merdivenci [1969], Siroky et al. [2006], Siroky et al. [2009] und Kolonin [2009] erstellt. Rot markiert ist das Verbreitungsgebiet der Zecke, grün jenes der Maurischen Landschildkröte. Ältere und nur teilweise berücksichtigte Meldungen über Funde dieser Zecken-Art stammen aus Frankreich, bei Bordeaux auf eingeführten Maurischen Landschildkröten, aus dem Südwesten Frankreichs auf Emys orbicularis (Linnaeus, 1758) (sic!), wobei jedoch im ⇒ Biotop, in dem die Europäische Sumpfschildkröte lebt, Hyalomma aegyptium natürlich sicher nicht vorkommt; sowie aus Griechenland und aus Rumänien.
Verbreitung: Bedingt durch die von mir vermuteten häufigen Fehlbestimmungen sind die Daten zur Verbreitung dieser Zecke wenig gesichert. In ihrem Verbreitungsgebiet, das von Marokko über den Nahen Osten bis in den Iran, Kirgisistan und Tadschikistan reicht, tritt diese Art offensichtlich nirgends ⇒ ubiquitär auf. Ich meine, dass diese Beobachtung auf die von mir angenommene, hohe Wirtsspezifität dieser Zecke zurückzuführen ist. Die hier präsentierte Verbreitungskarte dieser Zecken-Art im europäisch-mediterranen Bereich wurde aus Daten von Gemel et Hörweg [2011], Hassl [2003], Merdivenci [1969], Siroky et al. [2006], Siroky et al. [2009] und Kolonin [2009] erstellt. Rot markiert ist das Verbreitungsgebiet der Zecke, grün jenes der Maurischen Landschildkröte. Ältere und nur teilweise berücksichtigte Meldungen über Funde dieser Zecken-Art stammen aus Frankreich, bei Bordeaux auf eingeführten Maurischen Landschildkröten, aus dem Südwesten Frankreichs auf Emys orbicularis (Linnaeus, 1758) (sic!), wobei jedoch im ⇒ Biotop, in dem die Europäische Sumpfschildkröte lebt, Hyalomma aegyptium natürlich sicher nicht vorkommt; sowie aus Griechenland und aus Rumänien.
Bionomie: Es wird angenommen, dass diese Zecken-Art, so sie sich als Adulttiere nicht am Wirt befindet, in den Unterständen und Höhlen von Schildkröten in ⇒ arider Umgebung lebt. Ich glaube, sie lebt kavernikol und legt ihre Eier in den Untergrund der Unterstände. Möglicherweise verbringt sie sogar den größten Teil ihres Lebens auf ihrem Wirtstier. Denn es wird einerseits behauptet, dass es sich um eine typische drei-wirtige Zecke handelt, andererseits wurden aber von Siroky et al. [2006] alle Lebensstadien gleichzeitig auf einem Wirtstier gefunden. So eine Weise der Wirtsnutzung ist typisch für eine kavernikol lebende Art, die im Begriff ist, die Häufigkeit ihrer Wirtsakquisition zu verringern. Die Vermutung des häufigen Auftretens von Häutungen am Wirt wird von Kolonin [2009] bestätigt. Diese Beobachtung widerlegt zwar nicht die These der Drei-wirtigkeit, jedoch wäre das Verlassen eines weitgehend unbeholfenen Wirtes nur zum Zwecke der risikobehafteten Neuakquisition doch sehr unpraktisch und nachteilig für das Fortbestehen der Art. Der Lebenszyklus dauert mindestens 14 Wochen. Es könnte sich um eine Zecke mit einer Lebensdauer von ein- bis eineinhalb Jahren handeln, die als vollgesogene Nymphe oder als nüchterne Adulte im Boden, nie aber am Wirt überwintert. Ich glaube nicht, dass die Eier das Überwinterungsstadium sind. Es werden etwa dreimal so viele männliche Zecken auf den Schildkröten gefunden als weibliche, die Adulttiere sind ab April auf den Wirtstieren zu finden. Die vermutlich im Frühsommer geschlüpften Larven saugen um die Junimitte erstmals Blut an den Schildkröten, die Nymphen Ende Juli. Weibliche Schildkröten werden häufiger befallen als männliche, überwinternde Schildkröte- ei von Zecken. cit. Leontyeva et Kolonin [2002]. 1,3% der im Zuge des transnationalen Tierhandels nach Polen importierten Schildkrötenzecken waren auffällig missgebildet. cit. Nowak-Chmura [2012]. Dies ist ein relativ hoher Wert, der allerdings mit den Auswirkungen von chemischen Parasitenbekämpfungsmaßnahmen in den Reptilien-Zuchtstationen erklärt wird.
Wirte: Diese Zecken-Art ist wirtsspezifisch auf Gattungs-Niveau: Sie saugen nur an Landschildkröten der (gerafften) Gattung Testudo. In einer Studie wurde nur die Maurische Landschildkröte, Testudo graeca, ab einer Körperlänge von 8,8 cm als Wirt der adulten Zecken nachgewiesen. cit. Leontyeva et Kolonin [2002]. Allerdings ist die Hypothese der Wirtsspezifität auf Gattungsniveau, sicherlich unter Einbeziehung der Gattung Agrionemys, naheliegend und gut argumentierbar. cit. Siroky et al. [2006]. Daher sind Berichte, dass auch die Griechische Landschildkröte und die Breitrandschildkröte befallen werden, keine Überraschung. cit. Zlatanova [1991].  Das Bild links zeigt die typischen Prädilektionsstellen des Zeckenbefalls einer in der Westtürkei frei-lebenden Schildkröte, deren Lokalisation sich aus dem Habitus und dem Verhalten von mediterranen Schildkröten erklären lassen. cit. Hassl [2003].
Das Bild links zeigt die typischen Prädilektionsstellen des Zeckenbefalls einer in der Westtürkei frei-lebenden Schildkröte, deren Lokalisation sich aus dem Habitus und dem Verhalten von mediterranen Schildkröten erklären lassen. cit. Hassl [2003].
Unklar ist, ob die Bevorzugung der Maurischen Landschildkröte sich nicht schlichtweg auf deren Immunstatus, bedingt durch das saisonale ⇒ Aktivitätsmuster, zurückzuführen ist. Die Quantitäten der Blutkörperchen, die Werte der Serumparameter und der Immunstatus unterscheiden sich deutlich innerhalb des Jahreszyklus zwischen den mediterranen Schildkrötenarten. cit. Erler [2003b]. Insbesondere im Falle eines syntopen, aber quantitativ nicht gleichstarken Vorkommens und/oder der Nutzung derselben Unterschlüpfe ist das Saugen an den anderen Schildkrötenarten als an der Maurischen Schildkröte erklärbar. Ein Autor vertritt die Auffassung, dass diese Zecke in ihren Subadultstadien an einer breiten Palette an Wirtstier-Arten, an Säugetieren, Vögeln und Reptilien, Blut saugt, während sie in den Adultstadien mehr oder minder ⇒ stenophag ist. cit. Siroky et al. [2006]. Die Mutmaßung, dass der Südliche Weißbrustigel, Erinaceus concolor, ein geeigneter Wirt dieser Zecke ist, erscheinen bei genauerer Betrachtung der Belegfotos mit wenig Überzeugungskraft unterlegt zu sein. cit. Gazyagci et al. [2010].
Ein durch den Menschen hervorgerufener ⇒ Befall eines schlecht geeigneten Wirtes ist im Falle von Fundmeldungen aus dem Umfeld des Menschen nie auszuschließen, ebensowenig wie Fehldiagnosen. Daher erscheinen Meldungen, dass diese Zecke auch an Hunden, Hamstern, Pferden, Igeln und Vögeln erfolgreich Blut saugt, eher sehr unwahrscheinlich in ihrem Wahrheitsgehalt. In einer Übersichtsarbeit werden neben verschiedenen Schildkrötenarten, Agamen, der Igel und der Hamster als Wirte angeführt. cit. Sixl [1971b]. Diese Art wurde vom genannten Autor auch in der Steiermark aufgespürt - hier jedoch nicht auf einer heimischen Tierart, sondern auf Griechischen Landschildkröten. In dieser Publikation wurden keine Angaben zur Vergesellschaftung der Wirtstiere mit anderen Schildkrötenarten oder zur Richtigkeit der ⇒ Bestimmung der Schildkrötenart gemacht. Auf einem Schildkrötenexemplar konnten im April 1970 fünf Weibchen von Hyalomma aegyptium nachgewiesen werden. Die Schildkröten waren aus Mazedonien (früheres Jugoslawien) eingeführt worden, wobei über den Transport keine Angaben gemacht werden. Bei der Meldung, dass in der Türkei ein Männchen und vier Weibchen auf dem Menschen gefunden worden sind, handelt- vermutlich um einen reinen Zufall. cit. Bursali et al. [2010] und Bursali et al. [2013].

- Peregrine Wirte aller Stadien:
- Testudinata: Testudo graeca, Linnaeus, 1758 dt: Maurische Landschildkröte;
- T. hermanni Gmelin, 1789 dt: Griechische Landschildkröte;
- T. marginata Schoepf, 1789 dt: Breitrandschildkröte;
- Agrionemys (Testudo) horsfieldii (Gray, 1844) dt: Vierzehenschildkröte.
Vektorfunktion: Diese Zecken-Art ist als ⇒ Überträger von pathogenen Mikroorganismen auf Menschen, auf andere Säugetiere und auf Vögel wegen ihrer Wirtsspezifität weitgehend ungeeignet. Allerdings wurde in Algerien Rickettsia aeschlimannii Beati, Meskini, Thiers & Raoult 1997, ein humanpathogener spotted-fever-group-Erreger in diese Zecken mittels gentechnologischer Verfahren nachgewiesen. cit. Bitam et al. [2009]. Diese Zecken-Art fungiert allerdings vielleicht als ⇒ Reservoire für Anaplasma phagocytophilum (Foggie, 1949) Dumler et al., 2001, Ehrlichia canis (Donatien et Lestoquard, 1935), Borrelia turcica Güner et al., 2004, und Coxiella burnetii (Derrick, 1939). Telford [2009] und Siroky et al. [2009] berichten jedoch aus Nordafrika, Bulgarien, Griechenland und der Türkei, dass die Hämogregarienenart Hemolivia mauritanica (Sergent et Sergent, 1904) in Testudo graeca und T. marginata mit einer ⇒ Prävalenz von bis zu 92% gefunden werden kann, und Hyalomma aegyptium der spezifische und wahrscheinlich einzige andere Wirt und Vektor dieser Gregarine ist.
 Andreas R. Hassl
Andreas R. Hassl






