IX.0 Herpetophage Zecken
Inhaltsverzeichnis:
- IX.1Definitionen einer herpetophagen Milbe
- ❍Eine Liste aller bekannten herpetophagen Zecken
- IX.2Zecken und (andere) Milben auf Amphibien und Reptilien in Österreich
- ❍Eine Liste aller bekannten herpetophagen Schildzecken Österreichs
- ❍Die Beschreibung aller bekannten herpetophagen Schildzecken Österreichs
- IX.3Zecken-übertragene Krankheitserreger mit Reptilien-Bezug
- IX.4Eigene Publikationen, zum Thema passend
IX.1 Definitionen einer herpetophagen Milbe
Zecken und die populär als „Milben” bezeichneten Tiere sind zwei Gruppen von kleinen Spinnentieren aus der Unterklasse Acarina, in Deutsch: Milben. Zecken unterscheiden sich ⇒ morphologisch von anderen Milben-Taxa lediglich durch die Position der Stigmen und durch ihre größeren Körpermaße. Zecken sind ausschließlich Blut saugende, ⇒ permanente ⇒ Ektoparasiten von Landwirbeltieren. diese werden dann als ⇒ herpetophag bezeichnet, wenn sie sich tatsächlich von Körperflüssigkeiten von Amphibien oder Reptilien ernähren und sich dabei jeglicher eigenen physischen Schädigung entziehen. Fast alle ⇒ herpetophagen Zecken sind Mitglieder der Familie Ixodidae oder Schildzecken. Unter den in den Tropen heimischen Vertretern dieser Gruppe finden sich häufig Nahrungsspezialisten, es sind ⇒ stenoxene Parasiten. Diese ernähren sich gewöhnlich vom Blut nur einer oder sehr weniger Wirts-Taxa. Im Falle eines Nahrungsmangels attackieren sie häufig eine geringe Anzahl von weiteren Wirtstier-Arten, darunter gelegentlich auch den Menschen. Halter und Händler von frisch importierten, exotischen Herpetotaxa können so meist recht schmerzhafte Zeckenstiche davontragen. Unklar bleibt in solchen Fällen, ob das Blut dieses Notwirtes auch zur Weiterentwicklung der Zecke und zur Produktion befruchteter Eier führen kann.
Auffällig ist, dass sich zwar in jeder der drei Zeckenfamilien einige Vertreter oder zumindest ein Stadium mit ⇒ herpetophagen Neigungen finden lassen, ausgesprochene Spezialisten für den ⇒ Befall von Amphibien und Reptilien sind jedoch nur Schildzecken der tropischen Gattung Amblyomma. Eine stichhaltige Erklärung für dieses Faktum findet sich - neben der eher nichtssagenden Feststellung der höheren ⇒ Abundanz von ⇒ Herpetotaxa in den Tropen - nicht. Ich vermute, dass die Gattung Amblyomma ein anderes, von den anderen (Schild-)Zecken abweichendes Wirtserkennungssystem verwendet und deshalb, analog zu den Medizinischen Blutegeln in Europa, kaltblütige ⇒ Herpetotaxa als Wirte nutzen kann.
Eine Liste aller bekannten herpetophagen Zecken
Diese Originaltabelle (Tabelle 1) listet in einem weltweiten Maßstab alle Zecken-Arten auf, die am 06.03.23 als Blutsauger an Amphibien und Reptilien bekannt waren. Überdies werden einige Informationen zu ihrer Verbreitung, zum Wirtsspektrum und zu Besonderheiten bei-
- Herpetophage Zecken-Arten: 91.
- Davon befallen Individuen von 13 Arten auch den Menschen.
Zu Tab. IX.1: Die Abkürzungen und deren Erläuterungen:
L . . . Larve
N . . . Nymphe
A . . . Adulttier
W . . . Weibchen
M . . . Männchen
R . . . Region.
| Tab. IX.1: Die herpetophagen Zecken-Arten der Welt | ||||||||
|---|---|---|---|---|---|---|---|---|
| Zeckenart | Familie | herpetophages Stadium | Zoogeographische Region | Wirtstaxa | den Menschen befallend | Vektor für / Bemerkungen | ||
| Nuttalliella namaqua | Nuttalliellidae | N, W | Afrotropische R. | Skinke, Geckos, Gürtelechsen | ||||
| Argas brumpti | Argasidae | Afrotropische R. | Eidechsen | |||||
| Argas hoogstraali | Argasidae | Madagaskar | Oplurus fierinensis, O. quadrimaculatus, O. grandidieri | + | streng herpetophag | |||
| Argas transgariepinus | Argasidae | Afrotropische R. | Geckos | |||||
| Argas transversus | Argasidae | L, N, A (?) | Galapagos Inseln | Galapagos-Riesenschildkröte | vanishing species | |||
| Ornithodoros atacamensis | Argasidae | L | Neotropische R. (Chile) | Liolaemus bisignatus | ||||
| Ornithodoros faccinii | Argasidae | Neotropische R. (Brasilien) | Thoropa miliaris | |||||
| Ornithodoros galapagensis | Argasidae | L, N, A (?) | Galapagos Inseln | Drusenköpfe, Galapagos-Landleguane | vanishing species | |||
| Ornithodoros lahillei | Argasidae | Neotropische R. (Chile) | Philodryas chamissonis, Callopistes maculatus | |||||
| Ornithodoros microlophi | Argasidae | Nordchile | Microlophus atacamensis, Microlophus quadrivittatus | |||||
| Ornithodoros montenis | Argasidae | L | Argentinien | Rhinella arenarum | ||||
| Ornithodoros saraivai | Argasidae | Neotropische R. (Brasilien) | Cycloramphus boraceiensis | |||||
| Ornithodorus talaje | Argasidae | Panamensische & Neotropische R. | Felidae, experimentell: Schlangen | |||||
| Amblyomma albolimbatum | Ixodinae | Australische R. | Trachydosaurus rugosus | |||||
| Amblyomma albopictum | Ixodinae | Neotropische R. (Große Antillen) | Cyclura spp. | |||||
| Amblyomma antillorum | Ixodinae | Neotropische R. (Kleine Antillen) | Cyclura spp. | |||||
| Amblyomma boulengeri | Ixodinae | Galapagos Inseln | Kielschwanzleguane | vanishing species | ||||
| Amblyomma calabyi | Ixodinae | Australische R. | Warane | |||||
| Amblyomma chabaudi | Ixodinae | Madagaskar | Spinnenschildkröte, vielleicht auch andere Schildkröten | vanishing species | ||||
| Amblyomma clypeolatum | Ixodinae | Orientalische R. | Geochelone elegans | |||||
| Amblyomma cordiferum | Ixodinae | Orientalische R. | Schlangen | +? | parthenogenetische Vermehrung | |||
| Amblyomma crassipes | Ixodinae | Neotropische R. oder Orientalische R. | Eidechsen und Schlangen | |||||
| Amblyomma crassum | Ixodinae | Neotropische R. | Geochelone denticulata | |||||
| Amblyomma cruciferum | Ixodinae | Neotropische R. (Große Antillen) | Cyclura spp. | |||||
| Amblyomma darwini | Ixodinae | Galapagos Inseln | Amblyrhynchus cristatus | |||||
| Amblyomma dissimile | Ixodinae | Neotropische R. | Echsen, Schlangen, Rhinella marina | |||||
| Amblyomma elaphense | Ixodinae | Nearktische R. | Elaphe subocularis | monophag | ||||
| Amblyomma exornatum | Ixodinae | Afrotropische R. verschleppt nach N Amerika | Varanus spp. | ++ | Coxiella burnettii, Hämogregarine | |||
| Amblyomma falsomarmoreum | Ixodinae | Afrotropische R. | Testudo pardalis | |||||
| Amblyomma fimbriatum | Ixodinae | Australian R. | Warane, Eidechsen und Schlangen | Hepatozoon sp. | ||||
| Amblyomma flavomaculatum | Ixodinae | Afrotropische R. verschleppt nach N Amerika, vermutlich nicht in Australien | Varanus exanthematicus, Iguana iguana | |||||
| Amblyomma fulvum | Ixodinae | Neotropische R. | Eunectes marinus | |||||
| Amblyomma fuscum | Ixodinae | Neotropische R. | Squamata, Lizards | |||||
| Amblyomma geochelone | Ixodinae | Madagaskar | Astrochelys yniphora | monophag, vanishing species | ||||
| Amblyomma geoemydae | Ixodinae | Orientalische R. verschleppt nach N Amerika | Schildkröten, Warane, Vögel, Mensch | ++ | ||||
| Amblyomma gervaisi | Ixodinae | Paläarktische R. oder Orientalische | Eidechsen und Schlangen | |||||
| Amblyomma glauerti | Ixodinae | Australische R. | Varanus glebopalma, V. glauerti | |||||
| Amblyomma goeldii | Ixodinae | Neotropische R. nur Französisch Guiana | Reptilien | |||||
| Amblyomma hebraeum | Ixodinae | Afrotropische R. | Säugetiere, Vögel, selten: Schildkröten | |||||
| Amblyomma helvolum | Ixodinae | Paläarktische R. | Warane und Schlangen | |||||
| Amblyomma humerale | Ixodinae | Neotropische R. verschleppt nach N Amerika | Geochelone denticulata, Podocnemis sp., Bufo arenalis, Plica plica, Plica umbra | |||||
| Amblyomma komodoense | Ixodinae | Komodo Inseln | Komodowaran | monophager Endemit auf Komodo & Flores, vanishing species | ||||
| Amblyomma kraneveldi | Ixodinae | Orientalische R. (Sulawesi) | Python reticulatus, P. timorensis | |||||
| Amblyomma latum | Ixodinae | Afrotropische R. verschleppt Nearktische R. | Python regius, Varanus exanthematicus | |||||
| Amblyomma limbatum | Ixodinae | Australische R. | Warane, Eidechsen und Schlangen | Hepatozoon sp. | ||||
| Amblyomma macfarlandi | Ixodinae | Galapagos Inseln | Galapagos-Riesenschildkröte | monophager (?) Endemit auf Isabela, Santa Cruz, Santiago, vanishing species | ||||
| Amblyomma marmoreum | Ixodinae | M, W | Afrotropische R. verschleppt nach N Amerika | Geochelone spp. | Coxiella ruminantium | |||
| Amblyomma moreliae | Ixodinae | Australische R. | Warane, Eidechsen und Schlangen | Hepatozoon sp. | ||||
| Amblyomma nitidum | Ixodinae | Orientalische R. (Indien, Singapur) | Laticauda spp. | |||||
| Amblyomma nuttalli | Ixodinae | Afrotropische R. verschleppt nach N Amerika | Kinixys belliana, Geochelone pardalis, Varanus exanthematicus, Schlangen, Adulte auch Vögel & Säuger | ++ | Coxiella burnettii, Hämogregarine | |||
| Amblyomma orlovi | Ixodinae | Afrotropische R. | Python regius | |||||
| Amblyomma parvitarsum | Ixodinae | Neotropische R. | Subadulte: Reptilien | |||||
| Amblyomma pattoni | Ixodinae | Sino-Japanesisches R. | Schlangen | |||||
| Amblyomma pilosum | Ixodinae | Galapagos Inseln | Galapagos-Riesenschildkröte | monophager (?) Endemit auf Isabela & Santiago, vanishing species | ||||
| Amblyomma quadricavum | Ixodinae | Karibische Inseln (Große Antillen) | Epicrates spp., Alsophis spp. | |||||
| Amblyomma robinsoni | Ixodinae | Komodo Inseln | Komodowaran | monophager Endemit auf den Komodo-Inseln, vanishing species | ||||
| Amblyomma rotundatum | Ixodinae | Neotropische R. verschleppt nach N Amerika | Kröten, selten Reptilien | parthenogenetische Vermehrung | ||||
| Amblyomma sabanerae | Ixodinae | Panamanian R. verschleppt nach N Amerika | terrestrische und aquatische Schildkröten | |||||
| Amblyomma scutatum | Ixodinae | Panamaensische R., Neotropical R. | Leguane, Eidechsen, Schlangen | |||||
| Amblyomma soembawense | Ixodinae | Orientalische R. Indonesische Inseln | Varanus salvator, V. timorensis | |||||
| Amblyomma sparsum | Ixodinae | Afrotropische R. verschleppt nach N Amerika | Geochelone spp., Säuger | ? | ||||
| Amblyomma sphenodonti | Ixodinae | Neuseeland | Brückenechse, Tuatara | monophag ?, vanishing species | ||||
| Amblyomma squamosum | Ixodinae | Guam | Pazifikwaran | Endemit, vanishing species | ||||
| Amblyomma supinoi | Ixodinae | Orientalische R. | Geochelone elongata, Geoemydae spinosa, Melanochelis trijuga | |||||
| Amblyomma sylvaticum | Ixodinae | Afrotropische R. | Testudo angulata, Psammobates tentorius, Homopus areolatus | |||||
| Amblyomma testudinis | Ixodinae | Neotropische R. | nicht bekannt | |||||
| Amblyomma torrei | Ixodinae | Neotropische R. (Große Antillen) | Cyclura spp. | |||||
| Amblyomma (Africanella) transversale | Ixodinae | Afrotropische R. | Python sebae, P. regius | |||||
| Amblyomma trimaculatum | Ixodinae | Australische R. | Warane | |||||
| Amblyomma tuberculatum | Ixodinae | N, A | Florida und Umgebung | Georgia-Gopherschildkröte, Larven auf Säuger und Vögel | monophage Nymphe & Adulte, vanishing species | |||
| Amblyomma usingeri | Ixodinae | Galapagos Inseln | Chelonoidis nigra, Conolophus subcristatus | Endemit auf Isabela, vanishing species | ||||
| Amblyomma varanense | Ixodinae | Paläarktische R., Indochina, verschleppt nach N Amerika | Warane und Schlangen | |||||
| Amblyomma variegatum | Ixodinae | Afrotropische R. verschleppt nach N Amerika | Nutzvieh, auch auf Pyxis arachnoides gefunden | ++ | Coxiella ruminantium, Rickettsia africae | |||
| Amblyomma vikirri | Ixodinae | L, N, A | Südaustralien | Egernia stokesii, Tiliqua rugosa | ||||
| Amblyomma williamsi | Ixodinae | Galapagos Inseln | Drusenköpfe | vanishing species | ||||
| Bothriocroton glebopalma | Ixodinae | Australische R. | Warane | |||||
| Bothriocroton hydrosauri | Ixodinae | N (?) | Australische R. | Echsen, Schlangen, Schildkröten | Rickettsia honei | |||
| Bothriocroton undatum | Ixodinae | Australische R. | Warane, Echsen, Schlangen | |||||
| Haemaphysalis concinna | Ixodinae | N | Paläarktische R. (Europa) | Eidechsen | ++ | |||
| Haemaphysalis erinaceia | Ixodinae | W | Mediterraneum, Naher Osten | Kleinsäuger, Testudo hermanni | Zufallsfund | |||
| Haemaphysalis inermis | Ixodinae | L, N, A | Mittel- & Südeuropa | Säugetiere, selten auf Lacerta viridis | Rickettsia slovaca | |||
| Haemaphysalis sulcata | Ixodinae | L, (N) | Paläarktische R. | Echsen | Anaplasma ovis, Anaplasma phagocytophilum, Rickettsia felis | |||
| Hyalomma aegyptium | Ixodinae | L, N, A | Saharo-Arabische R. & Paläarktische R. | Testudo graeca, T. marginata | Haemolivia mauritanica | |||
| Hyalomma anatolicum excavatum | Ixodinae | Mediterraneum bis Afghanistan | Testudo hermanni | |||||
| Hyalomma marginatum | Ixodinae | W | Paläarktische R. | euryphage Art, Einzelfund auf Testudo graeca | + | |||
| Ixodes asanumai | Ixodinae | A | Japan | Eumeces okadae | ||||
| Ixodes ricinus | Ixodinae | L, N | Paläarktische R. | Lacerta agilis, L. viridis, Zootoca vivipara, Anguis fragilis, Coronella austriaca, Zamenis longissimus, Natrix natrix | +++ | diverse Erreger, hier speziell Borrelia lusitaniae | ||
| Ixodes inopinatus | Ixodinae | L, N (?) | Paläarktische R. | Psammodromus algirus | ||||
| Ixodes pacificus | Ixodinae | L, N | Nearktische R. | Sceloporus occidentalis | ++ ? | |||
| Ixodes trianguliceps | Ixodinae | L, N (?) | Paläarktische R. | Lacerta vivipara | FSME-Virus | |||
| Rhipicephalus rossicus | Ixodinae | Paläarktische R. | Rana arvalis, Lacerta agilis, L. viridis | ++ | CCHF-Virus, West-Nile-Virus, Coxiella burnettii, Francisella tularensis | |||
IX.2 Zecken und (andere) Milben auf Amphibien und Reptilien in Österreich

Abb. IX.1: Eine vollgesogene weibliche Schildzecke, vermutlich ein Exemplar einer Haemaphysalis-Art, hat sich am Ohreingang einer Lacerta viridis festgesogen. © I. Hassl.
Die aussagekräftigsten in Mitteleuropa durchgeführten Feldstudien ergaben, dass bis zu 75% der frei-lebenden Reptilien von Schildzecken, also Zecken aus der Familie Ixodidae, parasitiert werden. cit. Haklová-Kocíková et al. [2014]. Die Abbildung zeigt ein alltägliches Beispiel für diese Feststellung. Das Foto wurde während einer ⇒ herpetologischen Exkursion der ÖGH in der ungarischen Tiefebene aufgenommen. Selten finden sich jedoch in der Literatur Berichte über die Anwesenheit von blutsaugenden Kleinmilben an Reptilien, Amphibien-befallende Kleinmilben fehlen in der frei-lebenden, mitteleuropäischen Fauna gänzlich. Es steht somit in Frage, ob ein ⇒ Befall von frei-lebenden ⇒ Herpetotaxa mit blutsaugenden Milben in ⇒ Zentraleuropa in ungestörten Lebensräumen überhaupt auftritt. Im Gegensatz dazu können in Gefangenschaft lebende Reptilien massiv von parasitären Milben befallen sein, hingegen nur gelegentlich auch von Zecken, zumeist nicht näher bestimmter Art (unveröffentlichte Berichte von Tierärzten). Üblicherweise sind diese parasitär lebenden Arthropoden Objekte des Abscheus und der sofortigen Vernichtung. Ihre Bedeutung als Teil der einheimischen Fauna und als Regulatoren der Wirtspopulationen wird kaum jemals in Betracht gezogen.
Die in Österreich heimischen Vertreter von Zecken-Arten, deren potentielle Herpetophagie bekannt geworden ist, gehören allesamt zur Gruppe der ⇒ euryxenen Schildzecken. Sie können an einem breiten Spektrum von Wirtstier-Arten erfolgreich Blut saugen. Es sind durchwegs drei-wirtige Zecken, die für die Häutung oder das Eierlegen nach der Blutmahlzeit ihren Wirt regelmäßig verlassen. Herpetophagie findet sich bei den Zecken Österreichs in der Regel nur unter den juvenilen Entwicklungsstadien. Ausgenommen davon ist die ⇒ allochthone, ursprünglich mediterrane und streng Testudo-phage Art Hyalomma aegyptium (Linnaeus, 1758), die in allen Lebensstadien nur an Mediterranen Landschildkröten Blut saugt.
Bei den in Österreich aufgefundenen Zecken handelt es sich um heimische und in seltenen Fällen auch fremde Arten. Als heimisch gelten Tierarten dann, wenn sie in der gegenständlichen Region mindestens eine replizierende und sich selbst erhaltende Population etabliert haben, unabhängig von ihrem ⇒ autochthonen oder ⇒ allochthonen Ursprung. Die Grundvoraussetzung für die Etablierung einer Gründerpopulation durch einen neu ankommenden Parasiten ist allerdings die dauernde Verfügbarkeit von geeigneten Wirtstieren, während günstige Lebensräume und die meisten Umweltfaktoren zweitrangig sind. Exotische Zecken werden allerdings in einer großen Anzahl regelmäßig aus ihrer natürlichen Lebensräumen entnommen und einerseits durch im Tierhandel sich befindende Wirtsorganismen und andererseits durch nach ⇒ Zentraleuropa zurückkehrende Zugvögel in wenigen Tagen über weite Distanzen nach ⇒ Zentraleuropa verbracht. Allerdings kann keine fremde, herpetophage Zecken-Art in ⇒ Zentraleuropa eine existenzfähige Population etablieren ohne die Errichtung geeigneter Lebensräume durch den Menschen. Der Grund dafür sind die geringen ⇒ Abundanzen von ⇒ Herpetotaxa in ungestörten ⇒ Biotopen ⇒ ⇒ Zentraleuropas. Nur die artifiziellen Bedingungen in Terrarien und Freilandeinrichtungen für Haustiere fördern entscheidend die Akklimatisierung von nicht-heimischen Parasiten. cit. Nowak [2010b]. Die Popularität des Haltens exotischer ⇒ Herpetotaxa als Hausgenossen in den Städten Europas eröffnet ⇒ invasiven, parasitischen Milbenarten die Möglichkeiten zur Etablierung von ⇒ allochthonen Populationen, und zumindest eine Zecken-Art hat offensichtlich diese Chance auch wahrgenommen (Tabelle 2).
Eine Liste aller bekannten herpetophagen Schildzecken Österreichs
Diese Tabelle (Tabelle 2) listet im Freiland Österreichs oder in lokalen Freilandterrarien gefundene oder sehr wahrscheinlich in Österreich vorkommende Zecken-Arten auf, die am 06.03.23 als Blutsauger an Reptilien bekannt waren. Überdies werden einige Informationen zu ihrer Verbreitung, zum Wirtsspektrum und zu Besonderheiten beigestellt. cit. Hassl [2016].
- Herpetophage Zecken-Arten in Österreich: Sechs.
- Davon befallen Individuen von vier Arten auch den Menschen.
| Tab. IX.2: Die herpetophagen Zecken-Arten Österreichs | ||||||||
|---|---|---|---|---|---|---|---|---|
| Zeckenart | herpetophages Stadium | Vorkommen in Österreich | Wirtstaxa | anthro- pophag | Vektor für das Humanpathogen | Bemerkungen | ||
| Haemaphysalis concinna | N | nachgewiesen | Eidechsen | ++ | ||||
| Haemaphysalis inermis | L, N, A | vermutet | Säugetiere, selten auf Lacerta viridis | + | Rickettsia slovaca | |||
| Hyalomma aegyptium | L, N, A | nachgewiesen | Testudo graeca, T. marginata | synanthrope, allochthone Populationen (?) | ||||
| Hyalomma marginatum | W | sehr wahrscheinlich | euryphage Art, Einzelfund auf Testudo graeca | + | ||||
| Ixodes ricinus | L, N | nachgewiesen | Lacerta agilis, L. viridis, Zootoca vivipara, Anguis fragilis, Coronella austriaca, Zamenis longissimus, Natrix natrix | +++ | diverse Erreger, hier speziell Borrelia lusitaniae | extrem polyphage Art | ||
| Ixodes inopinatus | L, N (?) | nachgewiesen | Echsen | Exemplare dieser Art in Salzburg gefunden, jedoch nicht auf Reptilien | ||||
| Ixodes trianguliceps | L, N (?) | auf Reptilium nachgewiesen | Lacerta vivipara | FSME-Virus | unbestätigter Einzelfund | |||
Die Beschreibung aller bekannten herpetophagen Schildzecken Österreichs
In ⇒ Zentraleuropa sind keine Zecken- oder Milbenarten bekannt, die an Amphibien parasitieren, auch nicht aus purem Versehen. Die Gründe hierfür sind das Nicht-Überleben der ⇒ anurophilen, tropische Zecken der Gattung Amblyomma unter mitteleuropäischen Klimabedingungen einerseits (cit. Simmons et Burridge [2000]), und andererseits die Seltenheit von großen Ansammlungen von erwachsenen Amphibien am oder im Boden, die die Voraussetzung für das Existieren vo- agen Trombikuliden (chigger mites) sind.
Die Haltung und Zucht von Mediterranen Landschildkröten sind jedoch sehr häufige terraristische Aktivitäten in Österreich. Basierend auf einer 2002 erhobenen Schätzung (cit. Hassl [2004]), leben in mehr als 10 000 Haushalten in Österreich Schildkröten. In der Regel werden kleine Herden von ihnen in Freilandterrarien gehalten. In einigen Vorstädten ist die ⇒ Abundanz von in Gefangenschaft gehaltenen Landschildkröten höher als in der freien Natur der Herkunftsländer. Dadurch wurden ausreichend große Populationen von geeigneten Wirten geschaffen, um transalpine Populationen der mediterranen, ⇒ testudophilen Zecken-Art Hyalomma aegyptium zu etablieren. In Anbetracht des völligen Fehlens jeglicher Überprüfung auf das Vorliegen eines Zeckenbefalls durch die Tierhändler und die Käufer in Mitteleuropa (cit. Nowak [2010]a), scheinen bereits seit vielen Jahren ⇒ allochthone Populationen dieser Zecken-Art hierzulande zu existieren. Diese Zecken-Art wurde in Zentraleuropa, in der Steiermark, zum ersten Mal vor mehr als vierzig Jahren entdeckt (cit. Sixl [1971b]). Sie wird in lokalen Schildkrötenbeständen im Zuge eines parasitologischen Screenings hin und wieder diagnostiziert (nicht veröffentlichte Beobachtungen, teilweise eigene). Es ist eine streng ⇒ stenoxene Art, sie saugt nur an Testudo-Arten Blut. Diese drei-wirtige Zecke verhält sich ⇒ endophil in ⇒ Zentraleuropa, sie verbleibt ⇒ synanthrop in den Ruheboxen der Wirtstiere. Es ist aber nicht bekannt, wo genau die Häutungen stattfinden und wo und wie die einzelnen Zeckenstadien die Schildkröten befallen. Nur Adulttiere von Testudo graeca Linnaeus 1758 scheinen den Anforderungen dieser Zecke an ihren Wirt völlig zu entsprechen. Möglicherweise sind sogar nur ungewöhnlich in Erdhöhlen und -spalten lebende Exemplare oder Populationen dieser Schildkröte bestens geeignete Wirte - der mitteleuropäische „Schlechtwetterunterstand” als ideale Zecken-Brutstätte. Die saisonale Aktivität der Wirtspopulation ist vermutlich verantwortlich für die beobachtete Fluktuation in der Häufigkeit des Auffindens dieser Zecke (cit. Calisir et al. [2002]; Široký et al. [2009]; Gemel et Hörweg [2011]). Dennoch sind die entscheidenden Bedürfnisse für das Überleben dieser Zecke und das Gründen einer ⇒ allochthonen Population offensichtlich auch in einigen zentraleuropäischen, anthropogenen Schildkröten-Lebensräumen erfüllt.
Eine in Österreich sehr häufig gefundene und in breiten Bevölkerungsschichten bekannte Zecke ist Ixodes ricinus, der Holzbock. Weithin unbekannt ist aber die Herpetophagie dieser Zecke. Diese Art ist allerdings eine extrem ⇒ euryxene Zecke, die vermutlich wenig wählerisch versucht, so gut wie alle ihr zugänglichen Landwirbeltiere zu attackieren. Larven und Nymphen greifen terrestrische Säugetiere, Vögel und Reptilien gleicherweise an. Diese Zecke ist eine frei-lebende und im Freien blutsaugende Milbe, die mit Gestrüpp bewachsene Waldränder in den feuchten Talebenen bewohnt. Wenn I. ricinus Reptilien angreift, bevorzugt diese Zecke Tiere mit einem dauernden Bodenkontakt des Bauches. In bestimmten Regionen ⇒ ⇒ Zentraleuropas, zB dem Spessart, scheinen Eidechsen der wichtigste Wirt der subadulten Stadien dieser Zecken-Art zu sein. cit. Jansen [2002]. Eidechsen können von mehr als 100 Holzböcken zur gleichen Zeit befallen werden. cit. Malkmus [1995]. Es ist trotz des umfangreichen Wissens über diese Zecken-Art immer noch nicht bekannt, ob das Reptilienblut den Nährstoffbedürfnissen dieser Art genügt um sich erfolgreich häuten zu können und/oder befruchtete Eier zu legen.
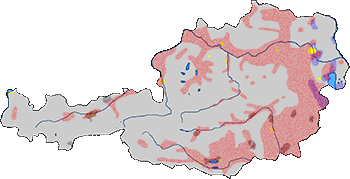
Abb. IX.2: Die bisher bekannt gewordenen Verbreitungsareale (fein gepunktet) von herpetophagen Schildzecken-Arten in Österreich. Ixodes ricinus in roter, Ixodes trianguliceps in schwarzer, und Haemaphysalis concinna in blauer Punktierung. Große Seen in Blau, Städte in Gelb. © A. Hassl.
Diese weit verbreitete Zecken-Art wird in feuchten Lebensräume von der Sumpf- oder Wühlmaus-Zecke Ixodes (Exopalpiger) trianguliceps ersetzt. Ähnlich ihres Eidechsen-Wirts, der Waldeidechse, Zootoca vivipara, reagiert diese Zecke erkennbar empfindlicher auf Trockenheit als andere Arten dieser Taxa und ist an Lebensräume mit hoher relativer Luftfeuchte gebunden. Die Zecke und die Eidechse können in Österreich in großen Höhen leben, die Zecke bis 2400 m über Meeresniveau. Beide Arten leben in jungen Waldbeständen auf den Lichtungen und den Mooren, und auf intensiv genutzten und gut strukturiert Wiesen und Weiden. Die Zecke wird als spezialisierter Blutsauger von Mäusen und Spitzmäusen angesehen, aber ihre Biologie ist weitgehend unbekannt. Die Sumpfzecke wurde nur einmal parasitierend an einem Reptil (Zootoca vivipara gefunden worden, und zwar in Polen. cit. Nowak-Chmura et Siuda [2012]. Deswegen kann die Herpetophagie dieser Zecken-Arten auch als Zufallsereignis gesehen werden.
Die Buschzecke, Haemaphysalis concinna, ist die typische xerothermophile Zecke von Wiederkäuer-Weiden. Diese Art ist ⇒ autochthon in Österreich, aber wahrscheinlich auf den Osten beschränkt. Siehe obige Abbildung. Sie bevorzugt warme, trockene Lebensräume, vor allem Schaf- und Rinder-Weiden, aber auch lockere Wälder mit dichtem Unterholz. In der Regel saugt sie an Landsäugetieren, aber im Falle von Hunger werden von den Nymphen auch Eidechsen und sogar Schlangen als Blutspender angenommen. cit. Hassl [2003]. Einige andere mitteleuropäische Haemaphysalis-Arten sind bekannt für ihre Herpetophagie, diese Arten wurden aber bislang in Österreich nicht nachgewiesen.
Das Vorhandensein von herpetophagen Milben in weitgehend natürlichen Lebensräumen ⇒ ⇒ Zentraleuropas wurde nie belegt, es existieren nur unbestätigte Berichte aus vom Menschen stark beeinflussten ⇒ Biotopen. Auch dort, in meist ⇒ synanthropen ⇒ Habitaten, jedoch außerhalb von Terrarien, ist ihre ⇒ Abundanz in der Regel vernachlässigbar gering. Details dazu unter Hassl [2016] in der Literaturliste.
IX.3 Zecken-übertragene Krankheitserreger mit Reptilien-Bezug
Einige mitteleuropäische Zecken-Arten sind sehr effektiv ⇒ Vektoren von Krankheitserregern, die von Zecken auf den Menschen übertragen werden. Aber es gibt nur einen durch Zecken übertragenen Erreger einer menschlichen Infektionskrankheit, der mit Reptilien assoziiert ist. Es ist dies das Bakterium Borrelia lusitaniae Le Fleche et al., 1997. Diese Spirochäte ist eine von mehreren lokalen Erregern, die eine Lyme-Borreliose beim Menschen verursachen. Sie wird ⇒ transstadial vom Holzbock, I. ricinus, übertragen, aber nicht ⇒ transovariell. Deshalb kann der Holzbock nicht als ⇒ Reservoir für das Bakterium fungieren. In ⇒ Zentraleuropa werden die Zauneidechse, Lacerta agilis, und die Mauereidechse, Podarcis muralis, als wichtigste Reservoirwirte angesehen. cit. Richter et Matuschka [2006]. In Lebensräume mit dichten syntopen Populationen beider Taxa, Holzböcken und Eidechsen, ist die Wahrscheinlich keit des Auftretens von B. lusitaniae-Spirochäten sehr hoch. Durch das Betreten solcher Lebensräume entsteht ein erhebliches Risiko für den Menschen, eine Lyme-Borreliose zu erwerben.
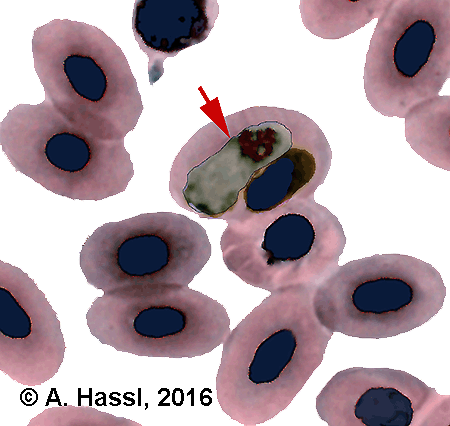
Abb. IX.3: Eine Hämogregarine (roter Pfeil) im Erythrozyten eines Reptils.
Ein bekanntes Beispiel für einen durch Zecken übertragenen Erreger einer Reptilienkrankheit ist die Infektion von Testudo graeca und Testudo marginata mit der Hämogregarine Hemolivia mauritanica (Sergent et Sergent, 1904). Im Maghreb und in den Ländern des Nahen Ostens wurde dieser apikomplexe Parasit in den Erythrozyten dieser Schildkröten mit einer ⇒ Prävalenzen von bis zu 92% nachgewiesen. cit. Široký et al. [2009]. Vektor und Endwirt dieses Parasiten sind ausschließlich Zecken der Art Hyalomma aegyptium. Die Infektion erfolgt über das Fressen der Zecken. Es ist nicht bekannt, ob die Schildkröten in ihren Ruhehöhlen nicht-angesaugte Zecken durch das Beknabbern von Erde fressen oder aber angesaugte Zecken von befallenen Artgenossen in einem Akt des konzertierten Groomings entfernen und sich dabei selbst gefährden.
IX.4 Eigene Publikationen, zum Thema passend
- A002 Hassl A, Aspöck H [1982]: Untersuchungen über die Möglichkeit der Einschleppung von durch Zecken übertragenen ARBO-Viren durch Vögel nach Mitteleuropa. Mitt Österr Ges Tropenmed Parasitol 4: 99-102.
- aktuell12 Hassl A [2003]: Die Zecke der mediterranen Testudo-Arten. ÖGH-aktuell 12: 12.
- aktuell12 Hassl A [2003]: Ectoparasite of lizards and possible vector: the mammal hard tickHaemaphysalis concinna KOCH, 1844. Herpetozoa 16 (1/2): 86-8.
- wikliwo116 Hassl A [2004]: Microbiological conservation medicine and exotic pets.Wiener klinische Wochenschrift, Wien; 116 (Suppl 4): 53-7.
- A292 Hassl A [2016]: Ticks and mites parasitizing free-ranging reptiles in Austria - with an identification key to Central European herpetophagous Acarina. Herpetozoa 29(1/2): 77-83.
 Andreas R. Hassl
Andreas R. Hassl